
【題目】將2.7g鋁粉分別與體積為100mL、濃度均為2mol/L的①硫酸溶液、②燒堿溶液、③鹽酸完全反應,放出氫氣的體積(相同條件)大小比較正確的是
A.①=②=③B.①=②>③C.①>②>③D.②>①=③
【答案】B
【解析】
n(Al)=![]() =0.1mol,n(H2SO4)=n(NaOH)=n(HCl)=2mol/L×0.1L=0.2mol;根據(jù)2Al~3H2SO4~3H2知,Al完全反應需要n(H2SO4)=0.15mol<0.2mol,則V(H2)=
=0.1mol,n(H2SO4)=n(NaOH)=n(HCl)=2mol/L×0.1L=0.2mol;根據(jù)2Al~3H2SO4~3H2知,Al完全反應需要n(H2SO4)=0.15mol<0.2mol,則V(H2)=![]() ×3×22.4L/mol=3.36L;根據(jù)2Al~2NaOH~3H2知,Al完全反應需要n(NaOH)=0.1mol<0.2mol,則V(H2)=
×3×22.4L/mol=3.36L;根據(jù)2Al~2NaOH~3H2知,Al完全反應需要n(NaOH)=0.1mol<0.2mol,則V(H2)=![]() ×3×22.4L/mol=3.36L;根據(jù)2Al~6HCl~3H2知,Al完全反應需要n(HCl)=0.3mol>0.2mol,則鹽酸不足量,
×3×22.4L/mol=3.36L;根據(jù)2Al~6HCl~3H2知,Al完全反應需要n(HCl)=0.3mol>0.2mol,則鹽酸不足量,![]() ×3×22.4L/mol=2.24L,所以①硫酸溶液、②燒堿溶液、③鹽酸完全反應,放出氫氣的體積關系(相同條件)是①=②>③,故答案為B。
×3×22.4L/mol=2.24L,所以①硫酸溶液、②燒堿溶液、③鹽酸完全反應,放出氫氣的體積關系(相同條件)是①=②>③,故答案為B。


 狀元坊全程突破導練測系列答案
狀元坊全程突破導練測系列答案科目:高中化學 來源: 題型:
【題目】準確稱取6.00克鋁土礦樣品(含Al2O3、Fe2O3、SiO2),將其放入盛有100毫升H2SO4溶液的燒杯中,充分反應后濾出沉淀物。在濾液X中加入10摩/升的NaOH溶液,產(chǎn)生的沉淀的質(zhì)量w與所加NaOH溶液的體積V之間有如圖所示的關系。求:
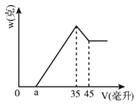
(1)分析圖象可知濾液X中所含有的溶質(zhì)成分為_____(填化學式)。
(2)H2SO4溶液的物質(zhì)的量濃度是__________?
(3)圖中a值為2.3毫升時,鋁土礦樣品中Fe2O3的質(zhì)量分數(shù)_________________。
(4)a值的變化范圍是____________________?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在一個2L的密閉容器中,X、Y、Z三種物質(zhì)的物質(zhì)的量隨時間的變化曲線如圖所示.根據(jù)圖中數(shù)據(jù)填空:

(1)反應開始至2min,以氣體Z表示的平均反應速率為_________.
(2)該反應的化學方程式為_________.
(3)若X、Y、Z均為氣體,2min后反應達到平衡,反應達平衡時:此時體系的壓強是開始時的_________倍;達平衡時,容器內(nèi)混合氣體的平均相對分子質(zhì)量比起始投料時_________(填"增大""減小"或"相等").
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學在實驗室進行鐵鹽與亞鐵鹽相互轉化實驗。
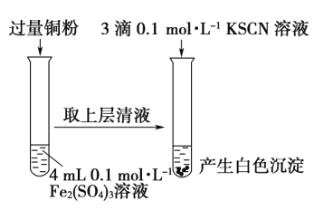
實驗Ⅰ:將![]() 轉化為
轉化為![]()
查閱資料:
已知:①![]() 的化學性質(zhì)與
的化學性質(zhì)與![]() 相似
相似
②![]()
實驗Ⅱ:將![]() 轉化為
轉化為![]()
實驗方案 | 現(xiàn)象 |
向 | 溶液變?yōu)樽厣胖靡欢螘r間后,棕色消失,溶液變?yōu)辄S色 |
查閱資料:![]() (棕色)
(棕色)
下列說法不正確的是
A.取![]() 溶液,向其中滴加3滴
溶液,向其中滴加3滴![]() 溶液,產(chǎn)生白色沉淀
溶液,產(chǎn)生白色沉淀
B.取![]() 溶液,向其中滴加3滴
溶液,向其中滴加3滴![]() 溶液,產(chǎn)生白色沉淀
溶液,產(chǎn)生白色沉淀
C.![]() 與
與![]() 反應的離子方程式為
反應的離子方程式為![]()
D.產(chǎn)生![]() 的原因:
的原因:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】FeCl3溶液在工業(yè)上用于蝕刻銅箔制造電路板。從蝕刻后的廢液中可以回收銅并使蝕刻液再生。流程如下(部分物質(zhì)有省略):

回答下列問題:
(1)氯化鐵溶液蝕刻銅箔反應的離子方程式為_______________________________________。
(2)從固體中分離出銅,加入的試劑X可以是________________。
(3)使濾液再生為蝕刻液可采用的方法是___________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在給定條件下,下列選項所示的物質(zhì)間轉化均能實現(xiàn)的是( )
A.MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO(s)
MgO(s)
B.H2SO4(濃)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
C.Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)![]() Fe(s)
Fe(s)
D.SiO2(s)![]() H2SiO3(膠體)
H2SiO3(膠體)![]() Na2SiO3(aq)
Na2SiO3(aq)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Deacon法制備Cl2的反應為4HCl(g)+O2(g)2Cl2(g)+2H2O(g)。如圖為恒容容器中,進料濃度比c(HCl)∶c(O2)分別等于1∶1、4∶1、7∶1時HCl平衡轉化率隨溫度變化的關系。下列說法正確的是( )
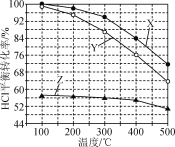
A.反應4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH>0
B.Z曲線對應進料濃度比c(HCl)∶c(O2)=7∶1
C.400 ℃,進料濃度比c(HCl)∶c(O2)=4∶1時,O2平衡轉化率為19%
D.400 ℃,進料濃度比c(HCl)∶c(O2)=1∶1時,c起始(HCl)=c0 mol·L-1,平衡常數(shù)K=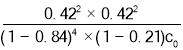
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁是地殼中含量最高的金屬元素,化學性質(zhì)活潑。
(1)在通常情況下,金屬鋁制品能穩(wěn)定地存在,不被氧化且不跟水作用,是因為______
(2)將在空氣中長時間放置的鋁條浸入6mol/L的氫氧化鈉溶液中,發(fā)現(xiàn)剛開始沒有氣泡,后來出現(xiàn)大量氣泡。出現(xiàn)這一現(xiàn)象的原因是(用文字和方程式表述)____________
(3)明礬是常見的凈水劑,寫出明礬凈水的原因(用文字和方程式表述)____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗研究發(fā)現(xiàn),硝酸發(fā)生氧化還原反應時,硝酸的濃度越稀,對應還原產(chǎn)物中氮元素的化合價越低。現(xiàn)一定量的鐵鋁合金與很稀的硝酸充分反應,反應過程中無氣體放出。在反應結束后的溶液![]() 中,逐滴加入
中,逐滴加入![]() 的氫氧化鈉溶液,所加氫氧化鈉溶液的體積(
的氫氧化鈉溶液,所加氫氧化鈉溶液的體積(![]() )與產(chǎn)生的沉淀的物質(zhì)的量(mol)的關系如下圖所示,則下列有關計算和判斷正確的是( )
)與產(chǎn)生的沉淀的物質(zhì)的量(mol)的關系如下圖所示,則下列有關計算和判斷正確的是( )
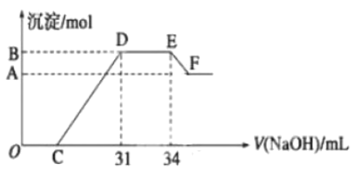
A.溶液![]() 中所含的陽離子有:
中所含的陽離子有:![]() 、
、![]() 、
、![]() 、
、![]()
B.在![]() 段,發(fā)生反應的離子方程式為
段,發(fā)生反應的離子方程式為![]()
C.無法求出![]() 點對應的沉淀的物質(zhì)的量
點對應的沉淀的物質(zhì)的量
D.![]() 點對應的氫氧化鈉溶液的體積為
點對應的氫氧化鈉溶液的體積為![]()
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com