
【題目】室溫下,用0.100 mol·L-1NaOH溶液分別滴定20.00 mL 0.100 mol·L-1的鹽酸和醋酸,滴定曲線如圖所示,下列說法正確的是

A.Ⅱ表示的是滴定醋酸的曲線
B.pH=7時,滴定醋酸消耗V(NaOH)小于20 mL
C.V(NaOH)=20.00 mL時,兩份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH)=10.00 mL時,醋酸溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
【答案】B
【解析】
試題分析:A、醋酸是弱電解質,HCl是強電解質,相同濃度的醋酸和HCl溶液,醋酸的pH>鹽酸,所以I是滴定醋酸的曲線,故A錯誤; B、pH=7時,溶液呈中性,醋酸鈉溶液呈堿性,要使溶液呈中性,則醋酸的體積稍微大于NaOH,所以滴定醋酸消耗的V(NaOH)小于20mL,故B正確; C、V(NaOH)=20.00mL時,兩種溶液中的溶質分別是醋酸鈉和NaCl,醋酸根離子水解、氯離子不水解,所以c(Cl﹣)>c(CH3COO﹣),故C錯誤; D、V(NaOH)=10.00mL時,醋酸溶液中的溶質為等物質的量濃度的CH3COOH、CH3COONa,醋酸電離程度大于醋酸根離子水解程度,溶液呈酸性,則c(H+)>c(OH﹣),再結合電荷守恒得c(Na+)<c(CH3COO﹣),故D錯誤,故選B 。


科目:高中化學 來源: 題型:
【題目】 溴乙烷在不同溶劑中與 NaOH 發生不同類型的反應,生成不同的反應產物。某 同學依據溴乙烷的性質,用右圖實驗裝置 (鐵架臺、酒精燈略) 驗證取代反應和消去 反應的產物,請你一起參與探究。

實驗操作Ⅰ:在試管中加入 5mL1mol/LNaOH 溶液和 5mL 溴乙烷,振蕩。 實驗操作 II:將試管如圖固定后,水浴加熱。
(1) 用水浴加熱而不直接用酒精燈加熱的原因是 。
(2) 觀察到 現象時,表明溴乙烷與 NaOH 溶液已完全 反應。
(3) 鑒定生成物中乙醇的結構,可用的波譜是 。
(4) 為證明溴乙烷在 NaOH 乙醇溶液中發生的是消去反應,在你設計的實驗方案中, 需要檢驗的是 ,檢驗的方法是 。
(需說明:所用的試劑、簡單的實驗操作及預測產生的實驗現象)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用芳香烴X和鏈烴Y可以合成紫外線吸收劑BAD, BAD的結構簡式為:

BAD的合成路線如下(己知G不能發生銀鏡反應,B遇FeCl3溶液顯紫色,C到D的過程是引入羧基的反應):
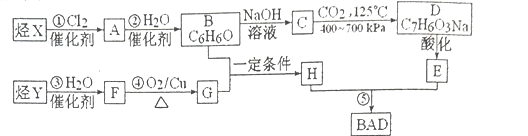
試回答下列問題:
(1)寫出Y的結構簡式________________;E的含氧官能團名稱_______________。
(2)屬于加成反應的有__________________(填數字序號)。
(3)1 mol BAD最多可與含________________mol NaOH的溶液完全反應。
(4)寫出下列反應的化學方程式:
反應④:______________________________;
F+E→:______________________________;
(5)E有多種同分異構體,寫出所有符合下列條件的同分異構體的結構簡式 _________________。
A.能發生銀鏡反應 B.遇FeCl3溶液顯紫色 C.核磁共振氫譜圖中有4個吸收峰
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解質溶液的電導率越大,導電能力越強。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 濃度均為 0.100 mol·L-1 的鹽酸和 CH3COOH 溶液。利用傳感器測得滴定過程中溶液的電導 率如圖所示。下列說法正確的是( )

A. 曲線①代表滴定 HCl 溶液的曲線
B. A 點溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同溫度下,A、B、C 三點溶液中水的電離程度:C<B=A
D. D 點溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】描述下列反應的現象并寫出反應的離子方程式。
(1)向FeCl3溶液中滴加NaOH溶液,現象:__________________,離子方程式:____________________
(2)向NaHCO3溶液中滴加稀H2SO4,現象:__________________,離子方程式:__________________
(3)稀HNO3和Ba(OH)2溶液混合,現象:__________________,離子方程式:____________________
(4)比較:上述三個離子反應發生的條件的不同點是______________________;相同點是________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,在10 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液,溶液的pH逐漸降低,此時溶液中含碳微粒的物質的量分數變化如圖所示(CO2因逸出未畫出,忽略因氣體逸出引起的溶液體積變化),下列說法正確的是

A. 在0.1 mol·L-1Na2CO3溶液中:c(Na+)+c(H+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(OH-)
)+c(OH-)
B. 當溶液的pH為7時,溶液的總體積為20 mL
C. 在B點所示的溶液中,離子濃度最大的是HCO![]()
D. 在A點所示的溶液中:c(CO![]() )=c(HCO
)=c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學——選修3:物質結構與性質]
H、C、N、O、Na、Fe、Cu是常見的七種元素,請回答下列問題:
(1)N、O、Na原子第一電離能由小到大的順序是 (用元素符號和“<”表示);Cu原子的特征電子軌道式為 。
(2)N、Na+、Fe3+、Cu2+四種微粒基態的核外電子排布式中未成對電子數最多的是_____;Cu2+在水中呈現藍色是因為形成了水合銅離子,其化學式為 ,水分子與銅離子間結合的化學鍵名稱為 。
(3)根據價層電子對互斥理論判斷下列分子或離子中空間構型是V形的是_____(填序號):①H3O+、②H2O、 ③NO2+ 、④NO2- 。
(4)分子(CN)2中鍵與鍵之間的夾角為180°,并有對稱性,分子中每個原子最外層均滿足8電子穩定結構,其結構式為 ,1個分子中含有____個![]() 鍵;(CN)2稱為“擬鹵素”,具有類似Cl2的化學性質,則(CN)2與NaOH水溶液反應的化學方程式為 。
鍵;(CN)2稱為“擬鹵素”,具有類似Cl2的化學性質,則(CN)2與NaOH水溶液反應的化學方程式為 。
(5)O和Na形成的一種只含有離子鍵的離子化合物,其晶胞結構如圖,該離子化合物的化學式為___________;已知該晶胞的密度為![]() ,阿伏加德羅常數為NA,求晶胞邊長a=________cm。(用含
,阿伏加德羅常數為NA,求晶胞邊長a=________cm。(用含![]() 、NA的代數式表示)。
、NA的代數式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com