
下列有關金屬腐蝕與防護的說法正確的是
| A.純銀器表面在空氣中會因化學腐蝕漸漸變暗 |
| B.地下輸油鋼管與外加直流電源的正極相連可保護其不受腐蝕 |
| C.海輪外殼連接鋅塊是采用犧牲陰極的陽極保護法保護外殼不受腐蝕 |
| D.當鍍錫鐵制品的鍍層破損時,錫鍍層仍能對鐵制品起保護作用 |
科目:高中化學 來源: 題型:單選題
用惰性電極電解硫酸銅溶液,整個過程轉移電子的物質的量與產生氣體總體積的關系如圖所示(氣體體積均在相同狀況下測定)。欲使溶液恢復到起始狀態,可向溶液中加入( )
| A.0.15 mol CuO | B.0.1 mol CuCO3 |
| C.0.075mol Cu(OH)2 | D.0.05 mol Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
電解裝置如圖所示,電解槽內裝有KI及淀粉溶液,中間用陰離子交換膜隔開。在一定的電壓下通電,發現左側溶液變藍色,一段時間后,藍色逐漸變淺。已知:3I2+6OH-=IO+5I-+3H2O,下列說法不正確的是( )
| A.右側發生的電極反應式:2H2O+2e-=H2↑+2OH- |
| B.電解結束時,右側溶液中含有IO3- |
C.電解槽內發生反應的總化學方程式:KI+3H2O KIO3+3H2↑ KIO3+3H2↑ |
| D.如果用陽離子交換膜代替陰離子交換膜,電解槽內發生的總化學反應不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
實驗室用鉛蓄電池作電源電解飽和食鹽水制取Cl2,已知鉛蓄電池放電時發生如下反應:
負極:Pb+SO42—-2e-=PbSO4
正極:PbO2+4H++SO42—+2e-=PbSO4+2H2O
今欲制得Cl2 0.050 mol, 這時電池內消耗的H2SO4的物質的量至少是( )。
| A.0.025 mol | B.0.050 mol | C.0.10 mol | D.0.20 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關原電池的說法中,正確的是( )
A.鋁片和鎂片用導線連接后插入NaOH溶液中,鎂片較活潑,作負極
B鋁片和銅片用導線連接后插入濃硝酸中,銅作負極
C.鍍鋅鐵和鍍錫鐵的鍍層破損后,前者較易被腐蝕
D.將反應2Fe3++Fe=3Fe2+設計為原電池,則可用鋅片作負極,鐵片作正極,FeCl3溶液作電解質
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
工業上利用H2在Cl2中燃燒,所得產物再溶于水的方法制得鹽酸,流程復雜且造成能量浪費。有人設想利用原電池原理直接制備鹽酸的同時,獲取電能,假設這種想法可行,下列說法肯定錯誤的是( )
| A.兩極材料都是石墨,用稀鹽酸作電解質溶液 |
| B.通入氫氣的電極為原電池的正極 |
| C.電解質溶液中的陽離子向通入氯氣的電極移動 |
| D.通氯氣的電極反應為Cl2+2e-=2Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在下列裝置中,MSO4和NSO4是兩種常見金屬的易溶鹽。當K閉合時,SO42-從右到左通過交換膜移向M極,下列分析正確的是( )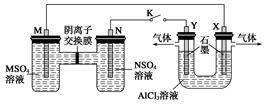
| A.溶液中c(M2+)減小 |
| B.N的電極反應式:N=N2++2e- |
| C.X電極上有H2產生,發生還原反應 |
| D.反應過程中Y電極周圍生成白色膠狀沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
依據氧化還原反應:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),設計的原電池如圖所示。下列有關說法中錯誤的是( )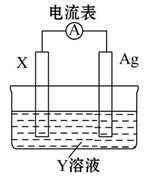
| A.電解質溶液Y是CuSO4溶液 |
| B.電極X的材料是Cu |
| C.銀電極為電池的正極,其電極反應為Ag++e-=Ag |
| D.外電路中的電子是從X電極流向Ag電極 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com