
【題目】某同學在實驗室中進行如下實驗:
編號 | Ⅰ | Ⅱ | Ⅲ |
實驗 |
|
|
|
現象 | 沒有明顯變化,溶液仍為無色 | 有沉淀生成,溶液為藍色 | 有無色氣泡產生 |
以下結論不正確的是
A.Ⅰ中無明顯變化,說明兩溶液不反應B.Ⅱ中的白色沉淀為BaSO4
C.Ⅲ中的化學方程式為2HCl+Zn=ZnCl2+H2↑D.Ⅲ中發生的反應是氧化還原反應
科目:高中化學 來源: 題型:
【題目】合成氨反應是重要的化工反應,請回答下列問題:
(1)①NH3(g)+![]() O2(g)
O2(g)![]() NO2(g)+
NO2(g)+![]() H2O(g) △H=-299.6kJ·mol-1
H2O(g) △H=-299.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
③N2(g)+2O2(g)=2NO2(g) △H=+33.9kJ·mol-1
由上述反應,可求出N2(g)+3H2(g)![]() 2NH3(g)的△H=___。
2NH3(g)的△H=___。
(2)對于反應①,在恒溫恒容(H2O為氣態)的容器中,下列選項表明反應已達到平衡的是___。
A.混合氣體的平均摩爾質量不變
B.混合氣體的密度不變
C.氣體的顏色不再變化
D.體系內壓強不再變化
E.每消耗1molNH3的同時生成1molNO2
(3)已知:N2(g)+3H2(g)![]() 2NH3(g)反應的熵變△S=-0.081kJ·mol-1·K-1,則298K時,該反應___(填“能”或“不能”)自發進行。
2NH3(g)反應的熵變△S=-0.081kJ·mol-1·K-1,則298K時,該反應___(填“能”或“不能”)自發進行。
(4)如圖為673K溫度下,某合成氨塔里各氣體組分壓強變化圖。
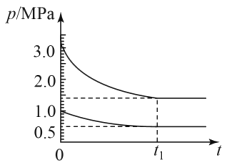
①t1平衡時,氨氣的體積分數為___%(保留位小數)。
②在圖中畫出氨氣組分壓強變化圖___。
③該溫度下N2(g)+3H2(g)![]() 2NH3(g)反應的壓力平衡常數Kp=___(MPa)-2(保留1位小數,Kp為以氣體分壓表示反應的平衡常數)
2NH3(g)反應的壓力平衡常數Kp=___(MPa)-2(保留1位小數,Kp為以氣體分壓表示反應的平衡常數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下10種化合物中,不能通過化合反應直接生成的有( )
①Fe3O4;②Fe(OH)3;③FeCl2;④CuS;⑤Cu2S;⑥Cu2(OH)2CO3;⑦Al(OH)3;⑧Na2CO3;⑨NaHCO3;⑩Na2O2
A.2種B.3種C.4種D.5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國西安兵馬傭二號坑出土的寶劍因含有鉻而鋒利無比。目前,工業用硬鉻尖晶石(屬于含氧酸鹽,主要含MN2O4其中M代表Mg或Fe,N代表Cr或Al)制備重鉻酸鈉(工業流程如圖),同時電解重鉻酸鈉溶液便可得到鉻。
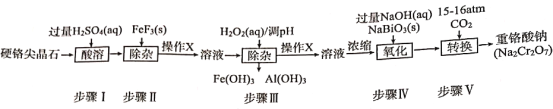
(1)硬鉻尖晶石中,Cr的化合價為__。
(2)在步驟II中除去的離子是___,操作X的名稱為___。
(3)寫出步驟III中H2O2表現的性質是___,已知步驟III所得溶液c(Cr3+)=0.010mol/L,常溫下,加NaOH使c(Fe3+)和c(Al3+)均降至10-5mol/L,應控制溶液的pH為___。(常溫下:[Ksp[Cr(OH)3]=1.0×10-32,Ksp[Al(OH)3]=1.0×10-35,Ksp[Fe(OH)3]=1.0×10-38]。
A.10~11 B.>11 C.約為10 D.約為4
(4)已知NaBiO3和Bi(OH)3都是難溶于水的固體。在步驟IV中發生化學反應的離子方程式為___,步驟V中CO2壓強越大Na2Cr2O7產率越高,其原因是___。
(5)工業上用電解法制備鉻,其裝置示意圖如圖:
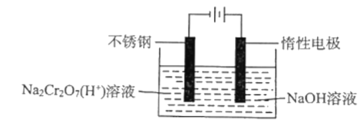
電解池工作時,陰極發生的電極反應式為___,該裝置的電能主要轉變為___能。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖實驗裝置用于驗證某些物質的性質。在試管A中裝入足量的固體NaHCO3。試回答下列問題:

(1)在A試管內發生反應的化學方程式是___________________。
(2)B裝置的作用是_____________________。
(3)在雙球干燥管內發生反應的化學方程式為______________________。
(4)雙球干燥管內觀察到的實驗現象是____________________________。
上述實驗現象說明____________________________。
(5)若將干燥管內的Na2O2換成Na2O,則雙球干燥管內觀察到的實驗現象是_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.因為3O2![]() 2O3是吸熱反應,所以臭氧比氧氣的化學性質更活潑
2O3是吸熱反應,所以臭氧比氧氣的化學性質更活潑
B.太陽能、煤氣、潮汐能是一次能源;電力、蒸汽、地熱是二次能源
C.吸熱反應就是反應物的總能量比生成物的總能量小的反應;也可以理解為化學鍵斷裂時吸收的能量比化學鍵形成時放出的能量少的反應
D.CO(g)的燃燒熱是283.0 kJ/mol,則2CO2(g)=2CO(g)+O2(g)反應的ΔH=-566.0kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向10.00mL濃度均為0.100molL-1的NaOH溶液和二甲胺[(CH3)2NHH2O]的混合溶液中逐滴加入鹽酸。利用傳感器測得該過程溶液中的陽離子總濃度變化曲線如圖;巳知二甲胺在水中電離與氨相似,常溫下Kb[(CH3)2NHH2O]=l.60×l0-4。下列說法正確的是( )
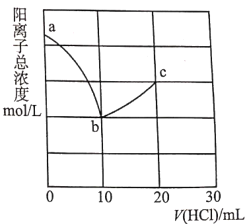
A.a點溶液中,c[(CH3)2NH2+]約為l.60×l0-4mol/L
B.從a到c的過程中,水的電離程度最大的是b點
C.c點溶液中:3c(Na+)+c[(CH3)2NH2+]=2c(Cl-)
D.V(HCl)=15.00mL時,c[(CH3)2NH2+]<c[(CH3)2NHH2O]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示中,A為一種常見的單質,B、C、D、E是含A元素的常見化合物,它們的焰色實驗均為黃色。
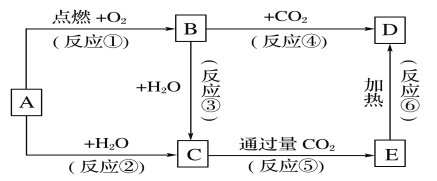
請填寫下列空白:
(1)寫出下列化學式:A____________,D____________
(2)以上反應中,不屬于氧化還原反應的有________________(填序號)。
(3)完成方程式
①A→C反應的離子方程式:______________________________________________,
②B→D反應的化學方程式:______________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的CO2氣體通入2L未知濃度的NaOH溶液中,在所得溶液中逐滴加入稀鹽酸至過量,并將溶液加熱,產生的氣體與HCl的物質的量的關系如圖所示(忽略氣體的溶解和HCl的揮發)下列說法正確是( )
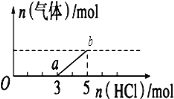
A.oa段反應的離子方程式為:H++OH-=H2O
B.O點溶液中所含溶質的化學式為NaHCO3、Na2CO3
C.標準狀況下,通入CO2的體積為4.48L
D.原NaOH溶液的物質的量濃度為2.5molL﹣1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com