
主要用于煤礦井下急救。某興趣小組擬選用如下裝置制備超氧化鉀(部分夾持儀器已略去)。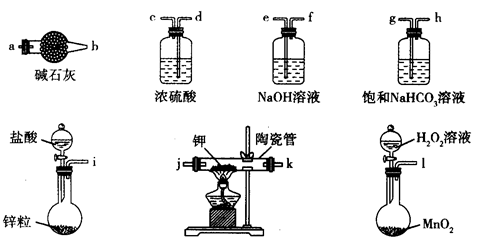
請回答下列問題:
(1)請選擇必要的裝置,按氣流方向的連接順序為_____________(填儀器接口的字母)。
(2)請根據完整的實驗裝置,完成下列實驗步驟:①_____________________;②裝入藥品,打開分液漏斗活塞;③持續通入氣體一段時間后,點燃酒精燈進行反應;④反應結束后,熄滅酒精燈,待反應管冷卻至室溫,停止通入氧氣,并關閉分液漏斗的活塞;⑤拆除裝置,取出產物。
(3)數據記錄如下:
根據數據計算可得實驗式KOx,則x=____________________。
(4)超氧化鉀可吸收二氧化碳,并生成氧氣,因此可以作為飛船、潛艇等密閉系統的氧氣再生劑。寫出超氧化鉀與二氧化碳反應的化學方程式:__________________________。與過氧化鈉相比,其優點是______________________________。
(1)lefdejka(jk可互換) (2分)
(2)檢測裝置的氣密性(2分)
(3)1.75(2分)
(4)4KO2+2CO2=2K2CO3+3O2(2分)相同質量的過氧化鈉和超氧化鉀相比,朝氧化鉀釋放的氧氣多。(2分)
解析試題分析:(1)根據超氧化鉀(KO2),容易與空氣中的水、二氧化碳等發生反應,因此制備的過程中一定要把裝置所含的水和二氧化碳除去,進入到陶瓷管中的氣體應先經過氫氧化鈉溶液除二氧化碳,再經過濃硫酸干燥,陶瓷管后面也要接一個裝有堿石灰的干燥管,防空氣中的水和二氧化碳與超氧化鉀接觸,故順序為:lefdejka(jk可互換);(2) 第一步應為檢查裝置的氣密性;(3)鉀的物質的量為:(15.19-14.80)/39=0.01mol,氧的物質的量=(15.47-5.19)/16=0.175mol,所以X=0.175mol/0.01mol=1.75;(4)過氧化鈉與CO2反應的方程式為2Na2O2+2CO2=2NaCO3+O2,KO2與CO2反應的方程式為4KO2+2CO2=2K2CO3+3O2,故其優點是相同質量的過氧化鈉和超氧化鉀相比,朝氧化鉀釋放的氧氣多。
考點:考查氧化還原反應及計算、化學實驗基本操作等知識點。


科目:高中化學 來源: 題型:實驗題
(18分)甲、乙兩個研究性學習小組為測定氨分子中氮、氫原子個數比,設計了如下實驗流程:
實驗中,先用制得的氨氣排盡洗氣瓶前所有裝置中的空氣,再連接洗氣瓶和氣體收集裝 置,立即加熱氧化銅。反應完成后,黑色氧化銅轉化為紅色的銅。下圖A、B、C為甲、乙兩小組制取氨氣時可能用到的裝置,D為盛有濃硫酸的洗氣瓶。
甲小組測得:反應前氧化銅的質量m1 g、氧化銅反應后剩余固體的質量m2g、生成氮氣在標準狀況下的體積V1L。乙小組測得:洗氣前裝置D的質量m3g、洗氣后裝置D的質量為m4g、生成氮氣在標準狀況下的體積V2L。請回答下列問題:
(1)檢查A裝置氣密性的操作是____________________________________________________。
(2)實驗室檢驗氨氣的操作和現象是____________________________________。
(3)甲、乙兩小組選擇了不同的方法制取氨氣,請將實驗裝置的字母編號和制備制備原理填寫在下表的空格中。
| | 實驗裝置 | 實驗藥品 | 制備原理 |
| 甲小組 | A | 氫氧化鈣、硫酸銨 | 反應的化學方程式為____________ |
| 乙小組 | _____ | 濃氨水、氫氧化鈉 | 用化學平衡原理分析氫氧化鈉的作用:_______ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某研究性學習小組,為了探究過氧化鈉的強氧化性,設計了如圖的實驗裝置。
實驗步驟及現象如下:
①檢查裝置氣密性后,裝入藥品并連接儀器。
②緩慢通入一定量的N2后,將裝置D連接好(導管末端未伸入集氣瓶中),再向圓底燒瓶中緩慢滴加濃鹽酸,反應劇烈,產生黃綠色氣體。
③一段時間后,將導管末端伸入集氣瓶中收集氣體。裝置D中收集到能使帶火星的木條復燃的無色氣體。
④反應結束后,關閉分液漏斗的活塞,再通入一定量的N2,至裝置中氣體無色。
回答下列問題:
(1)裝置B中的濕潤的紅色紙條褪色,證明A中反應有________(填化學式)生成。若B中改放濕潤的淀粉KI試紙,僅憑試紙變藍的現象不能證明上述結論,請用離子方程式說明原因___________________________________________。
(2)裝置C的作用是____________________________________________。
(3)甲同學認為O2是Na2O2被鹽酸中的HCl還原所得。乙同學認為此結論不正確,他可能的理由為①________;②________。
(4)實驗證明,Na2O2能與干燥的HCl反應,完成并配平該化學方程式。
該反應________(填“能”或“不能”)用于實驗室快速制取純凈的Cl2,理由是____________________________________________(要求答出要點)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
氫化鈣(CaH2)固體是登山運動員常用的能源提供劑。氫化鈣要密封保存,一旦接觸到水就發生反應生成氫氧化鈣和氫氣。氫化鈣通常用氫氣與金屬鈣加熱制取,圖1是模擬制取裝置:
(1)裝置B的作用是 ;裝置D的作用是 ;
(2)利用圖1實驗裝置進行實驗,實驗步驟如下:檢查裝置氣密性后裝入藥品;打開分液漏斗活塞, (請按正確的順序填入下列步驟的序號)。
①加熱反應一段時間 ②收集氣體并檢驗其純度
③關閉分液漏斗活塞 ④停止加熱,充分冷卻
(3)為了確認進入裝置C的氫氣已經干燥,應在B、C之間再接一裝置,該裝置中加入的試劑是: 。
(4)甲同學設計一個實驗,測定上述實驗中得到的氫化鈣的純度(雜質中不含鈣元素。請完善下列實驗步驟:
①樣品稱量;②加入________溶液(填化學式),攪拌、過濾;③________(填操作名稱);④_______ (填操作名稱); ⑤稱量碳酸鈣。
(5)乙同學利用注射器測量氫化鈣和水反應氫氣體積的方法,測定上述實驗中得到的氫化鈣的純度。他稱取46 mg 所制得的氫化鈣樣品,記錄開始時注射器活栓停留在10.00mL刻度處,反應結束后充分冷卻,活栓最終停留在57.04mL刻度處(上述氣體體積均在標準狀況下測定)。試通過計算求樣品中氫化鈣的純度: 。
(6)請你再設計一種氫化鈣純度的測定方法: 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
Ⅰ.(1)某化學興趣小組欲從下列裝置中選取必要的裝置制取(NH4)2SO4溶液,連接的順序(用接口序號字母表示)是:a 。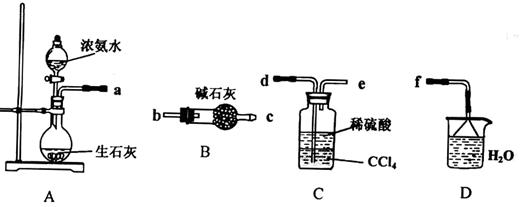
(2)將裝置C中兩種液體分離開的操作名稱是___ __。裝置D的作用是 。
Ⅱ.過氧化鈣可以用于改善地表水質、處理含重金屬粒子廢水和治理赤潮,也可用于應急供氧等。工業上生產過氧化鈣的主要流程如下: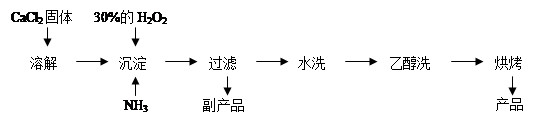
已知CaO2·8H2O呈白色,微溶于水。I2+2S2O32-= 2I-+S4O62-
(1)用上述方法制取CaO2·8H2O的化學方程式是 ;
(2)檢驗“水洗”是否合格的方法是 ;
(3)測定產品中CaO2的含量的實驗步驟是:
第一步:準確稱取a g產品于錐形瓶中,加入適量蒸餾水和過量的b g KI晶體,再滴入少量2 mol/L的H2SO4溶液,充分反應。
第二步:向上述錐形瓶中加入幾滴淀粉溶液。
第三步:逐滴加入濃度為c mol·L—1的Na2S2O3溶液至反應完全,消耗Na2S2O3溶液V mL。
①判斷此滴定實驗達到終點的方法是: 。
②CaO2的質量分數為 (用字母表示);
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
實驗室常用MnO2與濃鹽酸反應制備Cl2(反應裝置如圖所示)。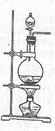
(1)制備實驗開始時,先檢查裝置氣密性,接下來的操作依次是__________(填序號)。
A.往燒瓶中加入MnO2粉末 B.加熱 C.往燒瓶中加入濃鹽酸
制備反應會因鹽酸濃度下降而停止。為測定已分離出過量MnO2后的反應殘余液中鹽酸的濃度,探究小組同學提出的下列實驗方案:
甲方案:與足量AgNO3溶液反應,稱量生成的AgCl質量。
乙方案:與已知量CaCO3(過量)反應,稱量剩余固體的質量。
丙方案:與足量Zn反應,測量生成的H2體積。
繼而進行下列判斷和實驗:
(2)判定甲方案不可行,理由是______________________________________________________。
(3)乙方案的實驗發現,固體中含有MnCO3,說明碳酸鈣在水中存在__________________,測定的結果會:______________________(填“偏大”、“偏小”或“準確”)。
進行丙方案實驗:裝置如圖所示(夾持器具已略去)。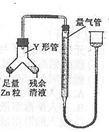
(4)使Y形管中的殘余清液與鋅粒反應的正確操作是將________轉移到______中。
(5)反應完畢,每間隔1分鐘讀取氣體體積,發現氣體體積逐漸減小,直至不變。 氣體體積逐次減小的原因是____________(排除裝置和實驗操作的影響因素)。
(6)小組內又有同學提出還可采用酸堿中和滴定法測定殘余液中鹽酸的濃度,但還需經查閱資料知道:________________________________________________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
化學實驗有助于理解化學知識,形成化學觀念,提高探究與創新能力,提升科學素養。
(1)在實驗室中用濃鹽酸與MnO2共熱制取Cl2并進行相關實驗。
①寫出該反應的離子方程式_________________________;
②下列收集Cl2的裝置正確裝置是_________________________;
③將Cl2通入水中,所得溶液中具有氧化性的含氯粒子是________________________;
④設計實驗比較Cl2和Br2的氧化性,操作與現象是:取少量新制氯水和CCl4于試管中,____________
_______________________________________________________________________________________。
(2)某化學興趣小組為了探究AgNO3的熱穩定性,設計了如下實驗。
用下圖所示的實驗裝置A加熱AgNO3固體,產生紅棕色氣體,在裝置D中收集到無色氣體。當反應結束以后,試管中殘留固體為黑色。
①裝置B的作用是___________________________。
②經小組討論并驗證該無色氣體為O2,其驗證方法是_____________________。
【查閱資料】Ag2O和粉末的Ag均為黑色;Ag2O可溶于氨水。
【提出假設】試管中殘留的黑色固體可能是:i Ag;ii Ag2O;iii Ag和Ag2O
| 實驗編號 | 操作 | 現象 |
| a | 加入足量氨水,振蕩 | 黑色固體不溶解 |
| b | 加入足量稀硝酸,振蕩 | 黑色固體溶解,并有氣體產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
亞鐵鹽中,FeSO4?7H2O露置于空氣中易被氧氣氧化,而莫爾鹽[(NH4)2SO4?FeSO4?6H2O]露置于空氣中不易被氧氣氧化,是一種重要的定量分析試劑。其制備原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4?FeSO4?6H2O。
實驗室用廢鐵屑制備莫爾鹽的過程如下:
(1)步驟I除銹的操作是:將廢鐵屑放入燒杯, ,過濾,洗滌。
(2)步驟II鐵屑的溶解在錐形瓶中進行,并水浴加熱到60℃左右,需要的儀器是鐵架臺、石棉網、大燒杯、 。
(3)步驟III中加入的(NH4)2SO4與溶液中FeSO4的物質的量需滿足的關系為:n[(NH4)2SO4]∶n[FeSO4]= 。
為了確定(NH4)2SO4的用量,下列方法簡便可行的是 (填編號)。
A.稱量廢鐵屑的質量,推算所需(NH4)2SO4的質量
B.稱量無銹鐵屑和步驟II之后剩余鐵屑的質量,推算所需(NH4)2SO4的質量
C.測定FeSO4溶液的濃度和體積,推算所需(NH4)2SO4的質量
(4)所得晶體樣品中可能混有的雜質是FeSO4·7H2O和(NH4)2SO4中的一種。某小組設計了如下方案進行檢驗和測定,請在答題卡上完成表中內容。
| 序號 | 實驗方案 | 實驗現象和結論 |
| 步驟1 | 取少量樣品 | 樣品顏色可能有變化。 |
| 步驟2 | 步驟1后將樣品轉移到試管中,加入去氧蒸餾水,振蕩溶解,調節至酸性,________ ___________ __ 。 | 若 ,說明樣品中含有FeSO4·7H2O雜質。 |
| 步驟3 | 若步驟2證明樣品不含FeSO4?7H2O雜質,再另取樣品測定其中NH4+的質量分數w1與理論值w2比較。 | 若w1 w2,說明樣品中含有(NH4)2SO4雜質。 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
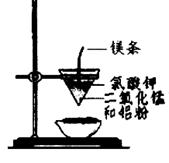
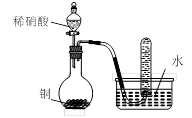
用下圖所示裝置進行實驗,不能達到實驗目的的是:( )
甲 乙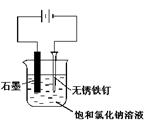
丙 丁
| A.用甲裝置比較硫、碳、硅三種元素的非金屬性強弱 |
| B.用乙裝置可制得金屬錳,用同樣的裝置可制得金屬鉻 |
| C.用丙裝置可實現對鐵釘的保護 |
| D.用丁裝置驗證銅與稀硝酸反應的氣體產物只有NO |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com