
【題目】已知A轉化為C和D分步進行:①A(g)![]() B(g)+2D(g)②B(g)
B(g)+2D(g)②B(g)![]() C(g)+D(g),其反應過程能量如圖所示,下列說法正確的是( )
C(g)+D(g),其反應過程能量如圖所示,下列說法正確的是( )
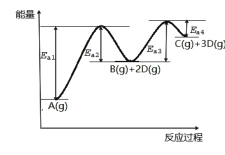
A.1molA(g)的能量低于1molB(g)的能量
B.B(g)![]() C(g)+D(g) ΔH=Ea4-Ea3
C(g)+D(g) ΔH=Ea4-Ea3
C.斷裂1molA(g)化學鍵吸收的熱量小于形成1molC(g)和3molD(g)化學鍵所放出的熱量
D.反應過程中,由于Ea3<Ea1,反應②速率大于反應①,氣體B很難大量積累
【答案】D
【解析】
A. 從圖中可知1molA(g)的能量低于1molB(g)和2molD(g)的總能量,不能比較1molA(g)的能量和1molB(g)的能量大小,A錯誤;
B. 從圖中反應前后能量變化可知,反應物總能量低于生成物總能量,B(g)![]() C(g)+D(g)為吸熱反應,ΔH>0,故ΔH=Ea3-Ea4,B錯誤;
C(g)+D(g)為吸熱反應,ΔH>0,故ΔH=Ea3-Ea4,B錯誤;
C. 從圖中可知,A轉化為C和D為吸熱反應,斷裂1molA(g)化學鍵吸收的熱量應大于形成1molC(g)和3molD(g)化學鍵所放出的熱量,C錯誤;
D. 從反應過程的圖像中可知, Ea3<Ea1,活化能越低,反應速率越快,故反應②速率大于反應①,氣體B很難大量積累,D正確;
答案選D。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化學 來源: 題型:
【題目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定條件下可實現如圖所示的物質之間的變化:
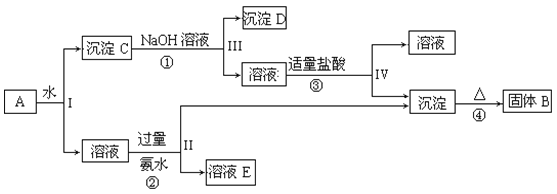
據此回答下列問題:
(1)I、II、III、IV四步中對于溶液和沉淀的分離采取的方法是___。
(2)根據上述框圖反應關系,寫出下列B、C、D、E所含物質的化學式。
固體B___;C__;沉淀D___;
(3)寫出①、②、③的離子方程式和④的化學方程式。
①___;
②___;
③___;
④____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)有一瓶無色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32離子。現進行以下實驗:
A、用pH試紙檢驗溶液,發現溶液呈強酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性變為堿性,無沉淀產生;
C、取少量B中的堿性溶液,滴加Na2CO3溶液,有白色沉淀產生。
①根據上述事實確定:該溶液中肯定存在的離子有_________________________;
肯定不存在的離子有___________________________。
②寫出C中發生反應的離子方程式________________________________。
(2)①還原鐵粉與高溫水蒸氣反應的化學方程式:_____________________________;
②除去Mg粉中的Al粉的試劑是__________________,反應的離子方程式為:___________________________________;
(3)高鐵酸鈉(Na2FeO4)具有強氧化性,可對自來水進行消毒、凈化。高鐵酸鈉可用氫氧化鐵和次氯酸鈉在堿性介質中反應得到,請補充并配平下面離子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反應11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化劑是___________;
當有2mol H3PO4生成,轉移的電子的物質的量為__________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸是極其重要的化工原料,在工業、農業、醫藥、軍事等領域應用廣泛。工業上通常用接觸法制硫酸,主要原料是硫鐵礦和空氣。接觸法制硫酸的生產過程大致可分為三個階段:二氧化硫的制取和凈化;二氧化硫轉化為三氧化硫;三氧化硫的吸收和硫酸的生成。為了防止環境污染并對尾氣進行綜合利用,硫酸廠常用氨水吸收尾氣的SO2、SO3等氣體,再向吸收液中加入濃硫酸,以制取高濃度的SO2及(NH4)2SO4和NH4HSO4固體。為了測定上述(NH4)2SO4和NH4HSO4固體混合物的組成,現稱取該樣品四份,分別加入相同濃度的NaOH溶液50.00mL,加熱至120℃左右,使氨氣全部逸出[(NH4)2SO4和NH4HSO4的分解溫度均高于200℃],測得有關實驗數據如下(標準狀況):
實驗 | 樣品的質量/g | NaOH溶液的體積/mL | 氨氣的體積/L(標準狀況) |
1 | 7.24 | 50.00 | 1.792 |
2 | 14.48 | 50.00 | 3.584 |
3 | 21.72 | 50.00 | 4.032 |
4 | 36.20 | 50.00 | 2.240 |
(1)由1組數據直接推測:1.81g樣品進行同樣實驗時,生成氨氣的體積(標準狀況)為___L。
(2)試計算該混合物中(NH4)2SO4和 NH4HSO4的物質的量之比為___。
(3)求所用NaOH溶液的物質的量濃度___mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人體內的血紅蛋白(Hb)可與O2結合,Hb也可以與CO結合,涉及原理如下:
反應①:Hb(aq)+O2(g)![]() HbO2(aq) ΔH1<0
HbO2(aq) ΔH1<0
反應②:Hb(aq)+CO(g)![]() HbCO(aq) ΔH2<0
HbCO(aq) ΔH2<0
反應③:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) ΔH3<0
HbCO(aq)+O2(g) ΔH3<0
下列說法不正確的是( )
A.ΔH1>ΔH2
B.反應①與反應②在較低溫度能自發進行
C.從平原初到高原,人體血液中c(HbO2)將降低
D.把CO中毒的人轉到高壓氧倉中,反應①平衡正移,c(HbO2)增大,反應③正移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體X可能含有Na2O2、Fe2O3、Al2O3、SiO2、K2SO4、Na2SO3、NH4NO3、MgCl2中的一種或幾種物質,進行如下實驗以確定其組成:
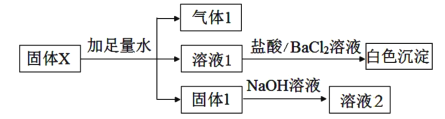
下列說法不正確的是( )
A.溶液1中不可能含有Cl-
B.氣體1可能是二種氣體的混合物
C.固體1可能是二種固體的混合物
D.固體X中,K2SO4和Na2SO3兩種物質至少含一種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組為探究二氧化硫的性質,按如圖所示裝置進行實驗。
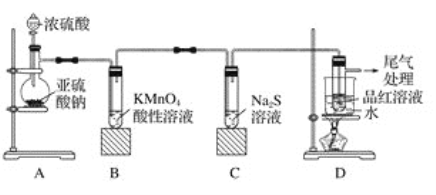
請回答下列問題:
(1)裝置A中盛放濃硫酸的儀器名稱是__________,反應的化學方程式為_______________。
(2)裝置B中的現象是__________________,反應的離子方程式為_________________。
(3)裝置C中的現象是______________,該現象說明二氧化硫具有的性質是_____________。
(4)裝置D的目的是探究二氧化硫與品紅作用的可逆性,寫出實驗操作及現象_____________。
(5)尾氣吸收發生反應的離子方程式為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,pH均為2的兩種一元酸HA和HB各1mL,分別加水稀釋,pH隨溶液體積的變化曲線如下圖所示。下列說法正確的是( )

A.HA的酸性比HB的酸性弱
B.a點溶液的導電性比c點溶液的導電性弱
C.若兩溶液無限稀釋,則它們的c(H+)相等
D.對a、b兩點溶液同時升高溫度,則![]() 增大
增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,4-環己二醇可通過下列路線合成:
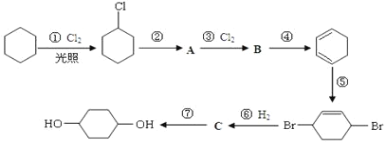
(1)寫出反應①、④、⑦的化學方程式:①____________;④____________;⑦____________。
(2)②的反應類型是____________,上述七個反應中屬于加成反應的有(填序號)____________。
(3)反應⑤中可能產生一定量的副產物,其可能的結構簡式為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com