
科目:高中化學 來源: 題型:單選題
蓋斯定律認為:不管化學過程是一步或分為數步完成,這個過程的熱效應是相同的。
已知:H2O(g)= H2O(l) △H1 =-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l) △H2 =-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3 = -Q3 kJ·mol-1(Q3>0)若使23g液態乙醇完全燃燒,最后恢復到室溫,則放出的熱量為(kJ)
| A.Q1+ Q2+Q3 | B.0.5(Q1+Q2+Q3 ) |
| C.0.5 Q1-1.5 Q2+0.5Q3 | D.1.5 Q1-0.5 Q2+0.5Q3 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列關于反應熱的說法正確的是
| A.當△H<O時,表示該反應為吸熱反應 |
B.已知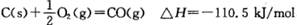 ,說明碳的燃燒熱為110kJ/mol ,說明碳的燃燒熱為110kJ/mol |
| C.反應熱的大小與反應物所具有的能量和生成物所具有的能量無關 |
| D.化學反應的反應熱只與反應體系的始態和終點狀態有關,而與反應的途徑無關 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知下列熱化學方程式:Zn(s) + 1/2 O2(g)= ZnO(s) △H1;Hg(l) + 1/2 O2(g)=HgO(s) △H2;
則 Zn(s)+ HgO(s)=Hg(l)+ ZnO(s),△H值為
| A.△H2-△H1 | B.△H2+△H1 | C.△H1-△H2 | D.-△H1-△H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
用Cl2生產某些含氯有機物時會產生副產物HCl。利用反應A,可實現氯的循環利用。
反應A:4HCl+O2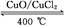 2Cl2+2H2O
2Cl2+2H2O
已知:Ⅰ.反應A中,4 mol HCl被氧化,放出115.6 kJ的熱量。
Ⅱ.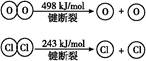
判斷下列說法正確的是( )
| A.反應A的ΔH>-115.6 kJ/mol |
| B.斷開1 mol H—O鍵與斷開1 mol H—Cl鍵所需能量相差約為32 kJ |
| C.H2O中H—O鍵比HCl中H—Cl鍵弱 |
| D.由Ⅱ中的數據判斷氯元素的非金屬性比氧元素強 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
根據以下3個熱化學方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-a kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-b kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-c kJ·mol-1(a、b、c均為正數)
對a、b、c三者大小關系的判斷正確的是( )
| A.a>b>c | B.a>c>b | C.c>b>a | D.b>a>c |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
25 ℃、101 kPa下,碳、氫氣、甲烷和葡萄糖的燃燒熱依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,則下列熱化學方程式正確的是( )。
A.C(s)+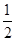 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 O2(g)=CO(g)ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=+571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D.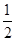 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知反應:①101 kPa時,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)
ΔH=-57.3 kJ/mol下列結論正確的是( )
| A.碳的燃燒熱的數值大于110.5 kJ/mol |
| B.①的反應熱ΔH為221 kJ/mol |
| C.濃硫酸與稀NaOH溶液反應的中和熱為-57.3 kJ/mol |
| D.稀醋酸與稀NaOH溶液反應生成1 mol水,放出57.3 kJ熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
現有兩個熱化學反應方程式: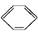 (l)+H2(g)
(l)+H2(g)
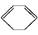 (l) ΔH>0①
(l) ΔH>0① 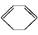 (l)+2H2(g)
(l)+2H2(g)
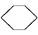 (l) ΔH<0②
(l) ΔH<0②
下列說法中不正確的是( )
| A.①②都屬于加成反應 |
| B.在通常條件下,①②都能自發進行 |
| C.①吸熱、②放熱的事實說明苯環中含有的并不是碳碳雙鍵 |
| D.①②中的所有有機物均可使溴水褪色,但褪色原理不完全相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com