
(16分)請運用化學反應原理的相關知識研究碳及其化合物的性質。
(1)我國儲氫納米碳管研究已取得重大進展。用電弧法合成的碳納米管中常伴有大量碳
納米顆粒(雜質),這種碳納米顆粒可用氧化氣化法提純,其反應的化學方程式為:
___C + ___K2Cr2O7 + _______= ___ CO2↑ + ___K2SO4 + ___Cr2(SO4)3 +___H2O
請完成并配平上述化學方程式。
(2)工業上一般以CO和H2為原料合成甲醇,該反應的熱化學方程式為:
CO(g)+ 2H2(g)  CH3OH(g)
△H1=-116 kJ·mol-1
CH3OH(g)
△H1=-116 kJ·mol-1
①下列措施中有利于增大該反應的反應速率的是____________。
A.使用高效催化劑 B.降低反應溫度
C.增大體系壓強 D.不斷將CH3OH從反應混合物中分離出來
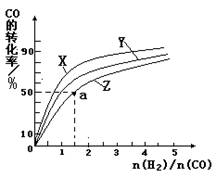
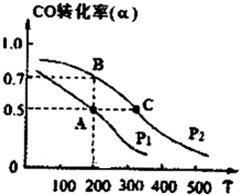
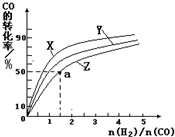
②在恒容容器中合成甲醇,當溫度分別為230℃、250℃和270℃時,CO的轉化率與n(H2)/n(CO)的起始組成比的關系如右圖所示。已知容器體積1L,起始時CO的物質的量均為1mol。據此判斷在上述三種溫度中,曲線Z對應的溫度是__________;利用圖中a點對應的數據,計算該反應在對應溫度下的平衡常數K =_______________________。
③已知: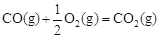 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
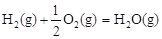 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
則表示1mol氣態甲醇完全燃燒生成CO 2和水蒸氣的熱化學方程式為_________。
(3)CO2在自然界循環時可與CaCO3反應,CaCO3是一種難溶物質,其溶度積常數Ksp=
c(Ca2+)·c(CO32—)=2.8×10−9。CaCl2溶液與Na2CO3溶液混合可形成CaCO3沉淀,現將等體積的CaCl2溶液與Na2CO3溶液混合,若Na2CO3溶液的濃度為5.6×10 -5 mol/L ,則生成沉淀所需CaCl2溶液的最小濃度為________________________。
(1)3C + 2K2Cr2O7 +8H2SO4 = 3CO2↑ + 2K2SO4 + 2Cr2(SO4)3 +8H2O(3分,填上H2SO4給1分)
(2)①AC(2分,各1分,多選或錯選1個倒扣1分,扣完為止,不出出負分)
②270℃(2分,無單位扣1分) 4L2/mol2(3分,不寫單位也給分)
③CH3OH(g)+3/2O2(g)
 CO2(g)+2H2O(g)
△H=-651kJ·mol-1(3分)
CO2(g)+2H2O(g)
△H=-651kJ·mol-1(3分)
(3)2×10-4mol/L(3分,不寫單位扣1分)
【解析】(1)考查氧化還原反應方程式的配平,配平的依據是電子的得失守恒。碳是還原劑,化合價升高4個單位。K2Cr2O7 是氧化劑,鉻元素的化合價降低3鉻單位,所以1mol氧化劑得到6mol電子,即氧化劑和還原劑的物質的量之比是2︰3,所以方程式為3C + 2K2Cr2O7 +8H2SO4 = 3CO2↑ + 2K2SO4 + 2Cr2(SO4)3 +8H2O。
(2)①考查外界條件對反應速率的影響。增大壓強或使用催化劑都能增大反應速率,AC正確,BD是降低反應速率。
②由于是放熱反應,所以溫度越高,CO的轉化率越低。因此Z表示的是270℃。a點的轉化率是50%,CO的起始濃度是1,則氫氣的是1.5,消耗的CO濃度是0.5,氫氣是1,生成甲醇是0.5,所以平衡常數=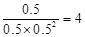 。
。
③考查蓋斯定律的應用。根據反應①CO(g)+ 2H2(g)  CH3OH(g)、②
CH3OH(g)、②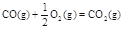
③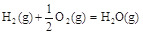 可知,②-①+③×2可得H3OH(g)+3/2O2(g)
可知,②-①+③×2可得H3OH(g)+3/2O2(g)  CO2(g)+2H2O(g),所以反應熱是-283 kJ·mol-1+116 kJ·mol-1-242 kJ·mol-1×2=-651kJ·mol-1。
CO2(g)+2H2O(g),所以反應熱是-283 kJ·mol-1+116 kJ·mol-1-242 kJ·mol-1×2=-651kJ·mol-1。
(3)根據Ksp= c(Ca2+)·c(CO32—)=2.8×10−9可知c(Ca2+)=Ksp/c(CO32—)=2.8×10−9/2.8×10 -5=1×10-4mol/L,所以所需CaCl2溶液的最小濃度為1×10-4mol/L×2=2×10-4mol/L


科目:高中化學 來源: 題型:閱讀理解
 (2013?淄博一模)請運用化學反應原理的相關知識研究元素及其化合物的性質.
(2013?淄博一模)請運用化學反應原理的相關知識研究元素及其化合物的性質.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 物質 溫度 |
活性炭(mol) | NO(mol) | E(mol) | F(mol) |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
- 3 |
2- 3 |
- 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年廣西桂林中學高三8月月考化學試卷(解析版) 題型:填空題
(12分)歐盟原定于2012年1月1日起征收航空碳排稅以應對冰川融化和全球變暖,使得對如何降低大氣中CO2的含量及有效地開發利用碳資源的研究顯得更加緊迫。請運用化學反應原理的相關知識研究碳及其化合物的性質
(1)用電弧法合成的儲氫納米碳管常伴有大量的碳納米顆粒(雜質),這種顆粒可用如下氧化法提純,請完成該反應的化學方程式:(系數按順序填在答題卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)活性炭可處理大氣污染物NO。在2 L密閉容器中加入NO和活性炭(無雜質),生成氣體E和F。當溫度分別在T1和T2時,測得各物質平衡時物質的量如下表:
|
物質 n/mol T/℃ |
活性炭 |
NO |
E |
F |
|
初始 |
2.030 |
0.100 |
0 |
0 |
|
T1 |
2.000 |
0.040 |
0.030 |
0.030 |
|
T2 |
2.005 |
0.050 |
0.025 |
0.025 |
①請結合上表數據,寫出NO與活性炭反應的化學方程式 。
②根據上述信息判斷,溫度T1和T2的關系是(填序號) 。
a.T1>T2 b.T1<T2 c.無法比較
(3)CO2經常用氫氧化鈉來吸收,現有0.4molCO2,若用200ml 3mol/LNaOH溶液將其完全吸收,溶液中離子濃度由大到小的順序為:
(4)CO還可以用做燃料電池的燃料,某熔融鹽燃料電池具有高的發電效率,因而受到重視,該電池用 Li2CO3 和 Na2CO3 的熔融鹽混合物作電解質, CO 為陽極燃氣,空氣與 CO2 的混和氣為陰極助燃氣,制得在 650 ℃下工作的燃料電池,其陽極反應式:2CO + 2CO32- =4CO2 +4e- 則 陰極反應式: ,電池總反應式: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com