
【題目】ClO2是一種高效安全的殺菌消毒劑。工業上可在較大電壓下電解氯化鈉先得到NaClO3再制備ClO2,其工藝原理示意圖如圖,下列說法正確的是( )
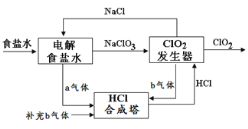
A.a氣體是氯氣,b氣體是氫氣
B.該裝置中氯化鈉電解槽陽極的電極方程式為:2Cl- - 2e- = Cl2↑
C.ClO2發生器中發生的反應:2ClO3- + 4H+ + 2Cl-=2ClO2↑ + Cl2↑ +2H2O
D.為使a、b氣體恰好完全反應,理論上每生產1mol ClO2需要補充44.8L b氣體(標準狀況)
科目:高中化學 來源: 題型:
【題目】在溫度T1和T2時,分別將0.50 mol CH4和1.20 mol NO2充入體積為1 L的密閉容器中,發生如下反應:CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g),測得n(CH4)隨時間變化數據如下表:
N2(g)+CO2(g)+2H2O(g),測得n(CH4)隨時間變化數據如下表:
時間/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列說法正確的是( )
A.該反應的ΔH>0、T1<T2
B.T2時CH4的平衡轉化率為30.0%
C.T2時40min后,斷裂4mol C-H鍵同時斷裂4 mol O-H鍵
D.T1時向平衡體系中再充入CH4,建立平衡后CO2的體積分數一定增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物X的分子式為C5H11Cl,用NaOH的醇溶液處理X,可得分子式為C5H10的兩種產物Y、Z,Y、Z經催化加氫后都可得到2甲基丁烷。若將化合物X用NaOH的水溶液處理,則所得有機產物的結構簡式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
科目:高中化學 來源: 題型:
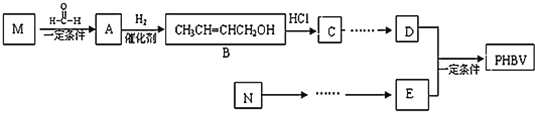
【題目】PHBV(![]() )是一種可降解的高分子材料。此類產品可用于食品包裝、化妝品、醫藥、衛生及農業等行業。它可由互為同系物的M、N(均為不飽和烴)等原料經下列路線合成:
)是一種可降解的高分子材料。此類產品可用于食品包裝、化妝品、醫藥、衛生及農業等行業。它可由互為同系物的M、N(均為不飽和烴)等原料經下列路線合成:
已知:RC≡CH+![]()
![]()
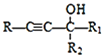
完成下列填空:
(1)寫出N的結構簡式______,C中官能團的名稱______。
(2)寫出反應類型:M→A______。B的同分異構體中能被新制氫氧化銅懸濁液氧化的有______種。
(3)由E和D合成PHBV的化學方程式是______。
(4)由乙醇制取乙酸的方法與過程可表述如下:C2H5OH![]() CH3CHO
CH3CHO![]() CH3COOH。請用上述表述方法表示由C合成D的方法與過程:______。
CH3COOH。請用上述表述方法表示由C合成D的方法與過程:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.某烷烴的名稱為2,2,4,4-四甲基-3,3,5-三乙基己烷
B.等質量的甲醛與乳酸[CH3CH(OH)COOH]完全燃燒消耗氧氣的量不相等
C.如圖是某有機物分子的比例模型,該物質可能是一種氨基酸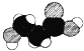
D.化合物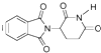 在酸性條件下水解,所得溶液加堿后加熱有NH3生成
在酸性條件下水解,所得溶液加堿后加熱有NH3生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用碳-碳偶聯反應合成新物質是有機合成的研究熱點之一,如:

化合物Ⅰ可以由以下合成路線獲得:

(1)化合物Ⅰ的分子式為__________________。
(2)化合物Ⅱ與溴的CCl4溶液發生加成反應,產物的結構簡式為______________________。
(3)化合物Ⅲ生成化合物Ⅰ的化學方程式為_____________;(注明反應條件)化合物Ⅲ與NaOH水溶液共熱的化學方程式為_____________。(注明反應條件)
(4)化合物Ⅳ是化合物Ⅲ的一種同分異構體,其苯環上只有一種取代基,Ⅳ的催化氧化產物Ⅴ能發生銀鏡反應。Ⅳ的結構簡式為_____________,Ⅴ的結構簡式為_____________。
(5)有機物 與BrMgCH2(CH2)3CH2MgBr在一定條件下發生類似反應①的反應,生成的有機化合物Ⅵ(分子式為C16H17N)的結構簡式為____________________。
與BrMgCH2(CH2)3CH2MgBr在一定條件下發生類似反應①的反應,生成的有機化合物Ⅵ(分子式為C16H17N)的結構簡式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應X(g)+3Y(g)![]() 2Z(g) △H的能量變化如下圖所示。下列說法正確的是
2Z(g) △H的能量變化如下圖所示。下列說法正確的是

A. △H= E2- E1 B. 更換高效催化劑,E3不變
C. 恒壓下充入一定量的氦氣n(Z)減少 D. 壓縮容器,c(X)減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業對國民經濟和社會發展具有重要意義,對于密閉容器中的反應:![]()
(1)寫出該反應的逆反應的化學平衡常數表達式______,升高溫度,該反應化學反應速率______,氫氣的轉化率______![]() 以上均填“增大”、“減小”或“不變”
以上均填“增大”、“減小”或“不變”![]() 。實際生產中溫度一般控制在
。實際生產中溫度一般控制在![]() ,原因是______。
,原因是______。
(2)能表示該反應在恒溫恒容密閉容器中![]() 時刻后已經達到平衡狀態的圖示是______。
時刻后已經達到平衡狀態的圖示是______。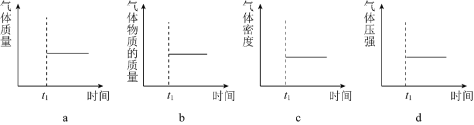
(3)濃度![]() 的氨水,pH為
的氨水,pH為![]() 當用蒸餾水稀釋100倍時,則
當用蒸餾水稀釋100倍時,則![]() 的電離平衡將向______方向移動
的電離平衡將向______方向移動![]() 填“正”或“逆”
填“正”或“逆”![]() ,溶液的pH將為______
,溶液的pH將為______![]() “大于”“小于”“等于”
“大于”“小于”“等于”![]() 。
。
設計一個簡單實驗,證明一水合氨是弱堿:______。
某化學興趣小組進行了下列關于氯化銨的課外實驗:
(實驗操作)
![]()
浸過氯化鈉溶液的布條很快燒光,浸過氯化銨溶液的布條不燃燒,冒出白煙。
(4)氯化銨飽和溶液中離子濃度由大到小的順序是______。白煙的成分是______。
(5)請推測浸過氯化銨溶液的布條不燃燒、不易著火的主要原因![]() 寫出一條即可
寫出一條即可![]() ______
______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。NaHA溶液顯酸性,則溶液中離子濃度的大小順序為__________________________。
H++A2-。NaHA溶液顯酸性,則溶液中離子濃度的大小順序為__________________________。
(2)已知常溫下H2A的鈣鹽(CaA)飽和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq)滴加少量Na2A固體,c(Ca2+)___(填“增大”“減小”或“不變”),原因是______。
Ca2+(aq)+A2-(aq)滴加少量Na2A固體,c(Ca2+)___(填“增大”“減小”或“不變”),原因是______。
(3)含有![]() 的廢水毒性較大,某工廠廢水中含4.00×10-3 mol·L-1的Cr2O
的廢水毒性較大,某工廠廢水中含4.00×10-3 mol·L-1的Cr2O![]() 。為使廢水能達標排放,作如下處理:
。為使廢水能達標排放,作如下處理:![]()
![]() Cr2+、Fe3+
Cr2+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①該廢水中加入FeSO4·7H2O和稀硫酸,發生反應的離子方程式為:_______。
②若處理后的廢水中殘留的c(Fe3+)=1×10-13 mol·L-1,則殘留的Cr3+的濃度為__________________。{已知:Ksp[Fe(OH)3]≈1.0×10-38 ,Ksp[Cr(OH)3]≈1.0×10-31}
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com