
【題目】常溫下,向![]() 溶液中滴加
溶液中滴加![]() 的NaOH溶液,所得溶液pH與加入的NaOH溶液體積的關系曲線如圖所示,下列說法正確的是
的NaOH溶液,所得溶液pH與加入的NaOH溶液體積的關系曲線如圖所示,下列說法正確的是 ![]()
![]()

A.a、b、c、d四個點中,水的電離程度最大的是d
B.a點溶液中:![]()
C.b點溶液中:![]()
D.c點溶液中:![]()
 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:
【題目】下列關于化學鍵及晶體的說法中,正確的是
A.Cl2、Br2、I2的沸點逐漸升高,是因為鍵能越來越大
B.N2和CCl4兩種分子中,每個原子的最外層都具有8電子穩定結構
C.金屬鈉的晶體采用簡單立方堆積,每個晶胞含1個原子,配位數為6
D.石英晶體和干冰晶體熔沸點不同,是因為所含化學鍵類型不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由N、F、S、Cl、Cu、Ni等元素組成的物質在生產、生活中有著廣泛的用途,回答下列問題.
(1)聚四氟乙烯是一種準晶體,該晶體是一種無平移周期序但有嚴格準周期位置序的獨特晶體.可通過________方法區分晶體、準晶體和非晶體,![]() 四氟乙烯分子中含
四氟乙烯分子中含![]() 鍵數目為________.
鍵數目為________.
(2)![]() 原子的價層電子軌道表達式
原子的價層電子軌道表達式![]() 價層電子排布圖
價層電子排布圖![]() 為________.
為________.
(3)![]() 、Cl、S電負性由大到小的順序為________.
、Cl、S電負性由大到小的順序為________.
(4)![]() 氟酸銻
氟酸銻![]() 是一種超強酸,離子
是一種超強酸,離子![]() 的空間構型為________,依次寫出一種與
的空間構型為________,依次寫出一種與![]() 具有相同空間構型和鍵合形式的分子和陰離子:________、________.
具有相同空間構型和鍵合形式的分子和陰離子:________、________.
(5)![]() 氟化銨
氟化銨![]() 可用作玻璃蝕刻劑、防腐劑、消毒劑等.
可用作玻璃蝕刻劑、防腐劑、消毒劑等.![]() 的中心原子的雜化類型是________;氟化銨中存在________
的中心原子的雜化類型是________;氟化銨中存在________![]() 填字母
填字母![]() .
.
A.離子鍵
B.![]() 鍵
鍵
C.![]() 鍵
鍵
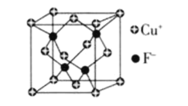
(6)![]() 的密度為
的密度為![]() ,CuF的晶胞結構如下圖.CuF的晶胞參數
,CuF的晶胞結構如下圖.CuF的晶胞參數![]() ________
________![]() 列出計算式
列出計算式![]() .
.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】陽離子交換膜電解槽運用到氯堿工業,使產品的純度大大提高,主要歸功于陽離子交換膜的嚴格把關,它只允許陽離子自由通過,其工作原理如圖所示。

(1)在氯堿工業中電解飽和食鹽水制備氫氣、氯氣和氫氧化鈉溶液時,飽和食鹽水的入口應該是______(填“C”或“D”)。
(2)該裝置也可用于物質的提純,工業品氫氧化鉀的溶液中含有某些含氧酸根雜質(如SO42-),可以用陽離子交換膜電解槽電解提純。除去雜質后氫氧化鉀溶液從液體出口_________(填“A”或“B”)導出。
(3)陽離子交換膜的誕生極大促進了電解工業的發展,我們不妨大膽設想,假設陰離子交換膜也已經誕生,同時使用陽離子交換膜和陰離子交換膜電解硫酸鈉溶液,可以同時制備產品氫氣、氧氣、氫氧化鈉溶液和硫酸溶液四種物質。某同學設計了如圖所示的裝置,請你指出硫酸鈉溶液的入口是_______(填“C”“G”或“D”)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某種鋰離子二次電池的總反應為FePO4(s)+ Li(s) ![]() LiFePO4(s)裝置如圖所示(a極材料為金屬鋰和石墨的復合材料)。下列說法不正確的是( )
LiFePO4(s)裝置如圖所示(a極材料為金屬鋰和石墨的復合材料)。下列說法不正確的是( )

A.圖中e―及Li+的移動方向說明該電池處于放電狀態
B.該電池中a極不能接觸水溶液
C.充電時a極連接外接電源的正極
D.充電時,b極電極反應式為:LiFePO4–e―= Li+ + FePO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】298K時,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的鹽酸,溶液的pH與所加鹽酸的體積關系如圖所示。己知0.10mol·L-1氨水的電離度為1.32%,下列有關敘述正確的是

A. 該滴定過程應該選擇酚酞作為指示劑
B. M點對應的鹽酸體積為20.0mL
C. M點處的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N點處的溶液中pH<12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,NaCN溶液中CN-、HCN濃度所占分數(δ)隨pH變化的關系如圖甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的鹽酸,其pH變化曲線如圖乙所示[其中a點的坐標為(9.5,0.5)]。

下列溶液中的關系中正確的是( )
A.常溫下,NaCN的水解平衡常數:Kh(NaCN)=10-4.5mol/L
B.圖甲中pH=7的溶液:c(Cl-)=c(HCN)
C.圖乙中b點的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.圖乙中c點的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷酸![]() 、亞砷酸
、亞砷酸![]() 是兩種弱酸。回答下列問題:
是兩種弱酸。回答下列問題:
(1)常溫下,向![]() 溶液中滴加
溶液中滴加![]() 溶液,混合溶液中由水電離的
溶液,混合溶液中由水電離的![]() 與KOH溶液的體積之間的關系如圖所示。
與KOH溶液的體積之間的關系如圖所示。

![]() 點對應溶液的pH________
點對應溶液的pH________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() __________。
__________。
![]() 在一定溫度下,向某容器中加入一定量的
在一定溫度下,向某容器中加入一定量的![]() 、
、![]() 和NaOH溶液,發生反應:
和NaOH溶液,發生反應:![]() ,
,![]() 的轉化率
的轉化率![]() 與時間的關系如圖所示,測得F點對應溶液中
與時間的關系如圖所示,測得F點對應溶液中![]() 、
、![]() ,且溶液
,且溶液![]() 。
。

![]() 點:
點:![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同
”,下同![]() ;E點的
;E點的![]() ______G點的
______G點的![]() 。
。
![]() 下列情況表明該反應達到平衡狀態的是__________
下列情況表明該反應達到平衡狀態的是__________![]() 填字母
填字母![]() 。
。
![]()
![]() 溶液顏色不再變化
溶液顏色不再變化
![]() 溶液的pH不再變化
溶液的pH不再變化 ![]() 溶液中
溶液中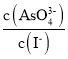 不再變化
不再變化
![]() 在該條件下,上述反應的平衡常數
在該條件下,上述反應的平衡常數![]() ____________
____________![]() 用含m的代數式表示
用含m的代數式表示![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在一定條件下xA+yB![]() zC達到平衡時,請填寫:
zC達到平衡時,請填寫:
①若A、B、C都是氣體,在減壓后平衡向逆反應方向移動,則x、y、z關系是___。
②已知B、C是氣體,現增加A的物質的量,平衡不移動,說明A是___(填狀態)。
③若容器容積不變,加入氣體B,氣體A的轉化率___(填“增大”“減小”或“不變”)。
④若加熱后,C的百分含量減小,則正反應是___反應(填“放熱”或“吸熱”)。
⑤和原平衡相比,加催化劑達到平衡時,氣體A的轉化率___(填“增大”“減小”或“不變”)。
⑥若容器容積不變,且A、B、C都是氣體,向容器中充入稀有氣體,則___。
A.化學平衡向正反應方向移動 B.化學平衡向逆反應方向移動
C.化學平衡不移動 D.反應停止
(2)甲醇(CH3OH)是重要的溶劑和替代燃料,工業上用CO和H2在一定條件下制備CH3OH的反應為:CO(g)+2H2(g)![]() CH3OH(g),在體積為1L的恒容密閉容器中,充入2molCO和4molH2,一定條件下發生上述反應,測得CO(g)和CH3OH(g)的濃度隨時間變化如圖一所示。
CH3OH(g),在體積為1L的恒容密閉容器中,充入2molCO和4molH2,一定條件下發生上述反應,測得CO(g)和CH3OH(g)的濃度隨時間變化如圖一所示。
①從反應開始到5min,用一氧化碳表示的平均反應速率v(CO)=____。

②下列說法正確的是___(填字母序號)。
A.達到平衡時,H2的轉化率為65%
B.5min后容器中混合氣體的平均相對分子質量不再改變
C.達到平衡后,再充入氬氣,反應速率減小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
③甲醇作為一種燃料還可用于燃料電池。在溫度為650℃的熔融鹽燃料電池中用甲醇、空氣與CO2的混合氣體作反應物,鎳作電極,用Li2CO3和Na2CO3混合物作電解質。該電池的負極反應式為_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com