
化學用語是學習化學的重要工具。下列用來表示物質變化的化學用語正確的是( )
| A.0.5mol/L氫氧化鈣溶液和0.5mol/L碳酸氫鎂溶液等體積混合反應:Ca2++ OH-+ HCO3=CaCO3↓+H2O |
| B.少量的SO2通入Ca(ClO)2溶液中反應的離子方程式為:SO2+H2O+Ca2++2ClO- = CaSO3↓+2HClO |
| C.將11.2L標準狀況下的氯氣通入200mL2mol/L的FeBr2溶液中,離子反應方程式為:2Fe2++8Br-+5Cl2=2Fe3++4Br2+10Cl- |
| D.某鋰電池電極總反應為:4Li+2SOCl2 = 4LiCl+S+SO2↑,則正極反應為:2SOCl2 + 4e-= 4Cl-+S +SO2↑ |
D
解析試題分析:氫氧化鈣溶液和碳酸氫鎂溶液等物質的量反應,Mg2+ + 2HCO3-+ Ca2+ + 2OH-=MgCO3 ↓+CaCO3 ↓+2H2O,A選項錯誤;少量的SO2通入Ca(ClO)2溶液中反應的離子方程式為:Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+,B選項錯誤;氯氣的物質的量是0.5mol,FeBr2的物質的量是0.4mol,它們的物質的量之比為5:4,4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-,C選項錯誤;分析反應的化合價變化,可得Li為還原劑,SOCl2為氧化劑,負極材料為Li(還原劑),發(fā)生氧化反應,電極反應式為Li-e-=Li+,正極發(fā)生還原反應,電極方程式為:2SOCl2+4e-=4Cl-+S+SO2↑,D選項正確。
考點:考查離子方程式和電極方程式。


科目:高中化學 來源: 題型:單選題
關于反應中的先后順序,下列評價正確的是
| A.向濃度都為0.1mol·L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反應 |
| B.向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反應 |
| C.向濃度都為0.1mol·L-1的FeCl3和CuCl2混合溶液中加入鐵粉,CuCl2首先反應 |
| D.向0.1mol·L-1的FeCl3溶液中加入質量相同、顆粒大小相同的鐵和銅,銅首先反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列離子在溶液中可大量共存,形成無色透明溶液的一組是
| A.K+、Na+、OH—、MnO4- | B.Ba2+、Cu2+、NO3—、SO42— |
| C.Mg2+、Na+、OH—、SO42— | D.Cl—、Ba2+、NO3—、OH— |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列離子方程式正確的是
| A.Cl2通入水中:Cl2+H2O=2H+ +Cl-+ClO- |
| B.雙氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
C.用銅作電極電解CuSO4溶液:2Cu2++2H2O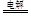 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| D.鋼鐵發(fā)生吸氧腐蝕時,鐵作負極被氧化:Fe - 3e- = Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列離子可以大量共存的是( )
| A.K +、SO42-、OH-、AlO2- | B.K +、Ag+ 、Cl-、NO3- |
| C.Ba2+ 、Na+ 、OH-、CO32- | D.Na+、NH4+ 、NO3-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列反應的離子方程式正確的是
| A.氯氣與水反應:Cl2 + H2O = 2H+ + Cl-+ ClO- |
| B.硫化亞鐵與稀硝酸反應:FeS + 2H+ = Fe2+ + H2S↑ |
| C.碳酸氫鈉溶液與稀硫酸反應:HCO3- + H+ = H2O + CO2↑ |
| D.檢驗氯化亞鐵溶液是否變質:Fe2++ 2SCN- = Fe(SCN)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
實驗室欲配制一種僅含有四種離子(不考慮來源水電離的離子)的溶液,且溶液中四種離子的濃度均相等,能達到此目的的是
| A.Na+、Mg2+、SO42—、Cl— | B.ClO—、I—、NH4+、Ba2+ |
| C.Na+、AlO2—、K+、HCO3— | D.Al3+、K+、SO42—、NO3— |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列解釋實驗現象的反應方程式正確的是 ( )
| A.切開的金屬Na暴露在空氣中,光亮表面逐漸變暗2Na+O2=Na2O2 |
| B.向AgCl懸濁液中滴加Na2S溶液,白色沉淀變成黑色2AgCl+S2-=Ag2S↓+2Cl- |
| C.Na2O2在潮濕的空氣中放置一段時間,變成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2 |
| D.向NaHCO3溶液中加入過量的澄清石灰水,出現白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知電離平衡常數:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有關離子反應或離子方程式的敘述中,正確的是( )
| A.向FeI2溶液中滴加少量氯水,反應的離子方程式為2Fe2++Cl2=3Fe3++2Cl- |
| B.向溴水中加入足量氯化亞鐵溶液能使溴水變成無色 |
| C.向NaClO溶液中通入少量CO2的離子方程式:2ClO-+CO2+H2O=2HClO+CO32- |
| D.能使pH試紙顯深紅色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com