
【題目】如圖裝置,A,B中的電極為多孔的惰性電極;C,D為夾在濕的Na2SO4濾紙條中心的鉑夾;電源有a、b兩極.若在A、B中充滿KOH溶液后倒立于KOH溶液的水槽中.切斷K1 , 閉合K2、K3通直流電,則:①標出電源的正、負極,a為極,b為極.
②在濕的Na2SO4溶液濾紙條中心的KMnO4液滴,有什么現象 .
③寫出電極反應式:
A中 .
B中 .
④若電解一段時間后,A、B中均有氣體包圍電極.此時切斷K2、K3 , 閉合K1 , 則電流表的指針是否移動(填是或否) . 若電流表指針不移動說明理由,若指針移動也說明理由 . 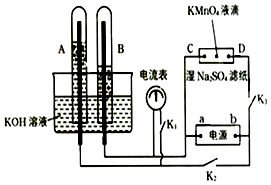
【答案】負;正;紫色向D方向移動,兩極有氣體產生;4OH﹣﹣4e=2H2O+O2↑;4H++4e=2H2↑;是;組成氫氧燃料電池
【解析】解:①切斷K1 , 合閉K2、K3通直流電,電極A、B及氫氧化鉀溶液構成電解池,根據離子的放電順序,溶液中氫離子、氫氧根離子放電,分別生成氫氣和氧氣,氫氣和氧氣的體積比為2:1,通過圖象知,B極上氣體體積是A極上氣體體積的2倍,所以B極上得氫氣,A極上得到氧氣,所以B極是陰極,A極是陽極,故a是負極,b是正極.
所以答案是:負;正;②浸有硫酸鈉的濾紙和電極C、D與電源也構成了電解池,因為a是負極,b是正極,所以C是陰極,D是陽極,電解質溶液中的陽離子鉀離子向陰極移動,陰離子高錳酸根離子向陽極移動,所以D極呈紫色;電解質溶液中氫離子和氫氧根離子放電,所以在兩極上都得到氣體.
所以答案是:紫色向D方向移動,兩極有氣體產生;③A極上氫氧根離子失電子生成氧氣和水,電極反應式為4OH﹣﹣4e=2H2O+O2↑;B極上氫離子得電子生成氫氣,電極反應式為4H++4e=2H2↑.
所以答案是:4OH﹣﹣4e=2H2O+O2↑;4H++4e=2H2↑;④切斷K2、K3 , 合閉K1 , 電解一段時間后,A、B中均有氣體包圍電極.此裝置構成氫氧燃料原電池,所以有電流通過,電流表的指針移動.
所以答案是:是;組成氫氧燃料電池.


 暑假作業海燕出版社系列答案
暑假作業海燕出版社系列答案 本土教輔贏在暑假高效假期總復習云南科技出版社系列答案
本土教輔贏在暑假高效假期總復習云南科技出版社系列答案 暑假作業北京藝術與科學電子出版社系列答案
暑假作業北京藝術與科學電子出版社系列答案 第三學期贏在暑假系列答案
第三學期贏在暑假系列答案科目:高中化學 來源: 題型:
【題目】周期表前四周期的元素A、B、C、D、E,原子序數依次增大.A的核外電子總數與其周期數相同,B的價電子層中的未成對電子有3個,C的s能級電子總數與p能級電子總數相等,D與C同族;E的最外層只有1個電子,但次外層有18個電子.回答下列問題:
(1)E+離子的基態核外電子排布
(2)B、C、D中第一電離能由大到小的順序為(填元素符號)
(3)A和B、C兩元素形成的兩種共價化合物發生反應,生成BA4+離子,該離子的中心原子的雜化方式為;與BA4+離子互為等電子體的一種分子為(填化學式).
(4)E的硫酸鹽溶液中滴加過量的氨水可以生成配合物[E(NH3)4]SO4 , 1mol配合物中含有的σ鍵的數目為 .
(5)E和C(空心小球為C,實心小球為E)形成的一種離子化合物的晶體結構如圖所示,則離子化合物的化學式為 . 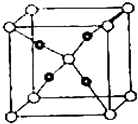
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 鎂合金密度雖小,但硬度和強度較大
B. 硅酸鈉的水溶液俗稱“水玻璃”,是一種建筑行業常用的黏合劑
C. 海水中含量最高的非金屬元素是氯元素
D. 根據纖維在火焰上燃燒產生的氣味,確定該纖維是否為蛋白質纖維。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】奈必洛爾是一種用于血管擴張的降血壓藥物.用于合成奈必洛爾中間體G的部分流程如圖: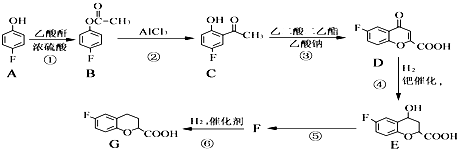
已知:乙酸酐的結構簡式為 ![]() 請回答下列問題:
請回答下列問題:
(1)G物質中的官能團的名稱是羧基,、 .
(2)反應A→B的化學方程式為 .
(3)上述④、⑤變化過程的反應類型分別是、 .
(4)寫出滿足下列條件的C的同分異構體的結構簡式:、Ⅰ.苯環上只有兩種取代基.Ⅱ.分子中只有4種不同化學環境的氫.
Ⅲ.能與NaHCO3反應生成CO2 .
(5)根據已有知識并結合相關信息,寫出以 ![]() 和乙酸酐為原料制備
和乙酸酐為原料制備 ![]() 的合成路線流程圖(無機試劑任選).
的合成路線流程圖(無機試劑任選).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的( )
A. 合金的熔點比其組成成分金屬的熔點高
B. SO2具有漂白性能使紫色石蕊試液先變紅后褪色
C. 因Fe、Al常溫下與濃硝酸反應,故不能用Fe或Al制器皿盛放濃硝酸
D. 液溴易揮發且密度大于水,保存時,用水封法
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組用工業碳酸鈣(主要成分為CaCO3;雜質為:Al2O3、FeCO3) 為原料,先制備無機鈣鹽,再與甲酸鈉溶液混合制取甲酸鈣.結合如圖幾種物質的溶解度曲線及表中相關金屬離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度為1.0molL﹣1計算),現提供的試劑有:a.甲酸鈉,b.5molL﹣1硝酸,c.5molL﹣1鹽酸,d.5molL﹣1硫酸,e.3%H2O2溶液,f.澄清石灰水.
金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
請補充完整由碳酸鈣制備甲酸鈣的實驗步驟
步驟1.稱取13.6g甲酸鈉溶于約20mL水,配成溶液待用,并稱取研細的碳酸鈣樣品10g待用.
步驟2. .
步驟3. .
步驟4.過濾后,將濾液與甲酸鈉溶液混合,調整溶液pH 7~8,充分攪拌,所得溶液經、、洗滌干燥得甲酸鈣晶體.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組為探究SO2的性質,按如圖所示裝置進行實驗. 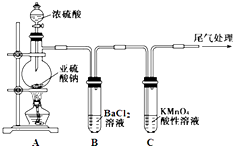
已知:Na2SO3+H2SO4(濃) ![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
請回答下列問題:
(1)裝置A中盛放濃硫酸的儀器名稱是 .
(2)實驗過程中,C中的現象是 , 說明SO2具有性.
(3)實驗過程中,觀察到裝置B中出現了明顯的白色沉淀.為探究該白色沉淀的成分,該小組同學進行了如下實驗: ![]()
根據實驗事實判斷該白色沉淀的成分是(填化學式),產生該白色沉淀的原因可能是(填字母編號).
a.BaSO3既不溶于水也不溶于酸 b.BaCl2溶液中可能溶解有氧氣
c.BaCl2溶液中可能混有NaOH d.由A制得的SO2氣體中可能混有氧氣
(4)如果將裝置A中的濃H2SO4換作濃HNO3 , 對此實驗是否有影響并明理由 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com