下列說法不正確的是( )
A.某固體物質的不飽和溶液轉化為飽和溶液時,溶液中溶質的質量分數有可能不改變
B.質量相同溶質質量分數也相同的鹽酸和稀硫酸,分別與足量的金屬鋅反應,生成氫氣的質量一定相等
C.將密度為1.84 g/cm3溶質質量分數為98%的濃硫酸稀釋為49%的硫酸,所加水的體積與所取濃硫酸的體積一定相等
D.一定質量Cu(OH)2和CuO的混合物,與98 g溶質質量分數為10%的稀硫酸恰好完全反應后,所得溶液中溶質的質量一定為16 g
【答案】
分析:A、用降溫的方法降低物質的溶解度將飽和溶液轉化為飽和溶液時,溶質的質量分數不變;
B、質量相同溶質質量分數也相同的鹽酸和稀硫酸中溶質的質量相等,分別與足量的金屬鋅反應,生成氫氣的質量應等于溶質中氫元素的質量,又因為氯化氫中氫元素的質量分數大于硫酸中氫元素的質量分數,所以生成氫氣的質量鹽酸多;
C、因水的密度為1g/cm
3,比濃硫酸的密度小,因此將98%的濃硫酸稀釋為49%的硫酸加水的體積應比濃硫酸的體積大;
D、氫氧化銅和氧化銅與硫酸反應都生成硫酸銅,硫酸銅是溶質,因恰好完全反應,所以生成硫酸銅的質量可由硫酸的質量計算得出,先計算出硫酸的質量,然后計算出硫酸中硫酸根的質量,用硫酸根的質量除以硫酸根在硫酸銅中的質量分數即可得到溶質硫酸銅的質量.
解答:解:A、用降溫的方法降低物質的溶解度將飽和溶液轉化為飽和溶液時,溶質的質量分數不變,故說法正確;
B、質量相同溶質質量分數也相同的鹽酸和稀硫酸中溶質的質量相等,分別與足量的金屬鋅反應,生成氫氣的質量應等于溶質中氫元素的質量,又因為氯化氫中氫元素的質量分數大于硫酸中氫元素的質量分數,所以生成氫氣的質量鹽酸多,故說法錯誤;
C、因水的密度為1g/cm
3,比濃硫酸的密度小,因此將98%的濃硫酸稀釋為49%的硫酸加水的體積應比濃硫酸的體積大,不能相等,故說法錯誤;
D、98g溶質質量分數為10%的稀硫酸中硫酸的質量為98g×10%=9.8g,9.8g硫酸中硫酸根的質量為9.8g×(
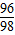
×100%)=9.6g,所以生成的溶質硫酸銅的質量為9.6g÷(
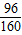
×100%)=16g,故說法正確;
故選BC.
點評:本題難度很大,D選項解題的關鍵是掌握有關反應的情況以及硫酸中硫酸根的轉化,而后利用反應前后硫酸根的質量不會改變解答即可.

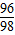
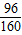 ×100%)=16g,故說法正確;
×100%)=16g,故說法正確;

