分析:由標簽可知化肥K2SO4含量≥86%,要判斷該化肥是否符合包裝說明,只要算出4.0g化肥樣品中K2SO4的質量分數即可.K2SO4與氫氧化鋇發生了如下反應:Ba(OH)2+K2SO4=BaSO4↓+2KOH.讀圖可知,生成沉淀的質量為4.66g,作為已知量,根據化學方程式可計算出K2SO4的質量,進一步算出化肥的質量分數,與86%比較.
解答:解:①設--------設4.0g鉀肥樣品中含有硫酸鉀的質量為x
②寫--------Ba(OH)
2+K
2SO
4=BaSO
4↓+2KOH
③找------------------174 233
X 4.66g
④列-------
= ⑤解--------解得:X=3.48g
則這種鉀肥樣品中硫酸鉀的質量分數為:
×100%═87%
由于87%>86%,該鉀肥中硫酸鉀的質量分數符合產品包裝說明.
⑥答:該鉀肥中硫酸鉀的質量分數為87%,該產品符合包裝說明.
點評:該題屬于標簽圖象型計算題,主要考查讀圖能力,注意解題的格式要規范.

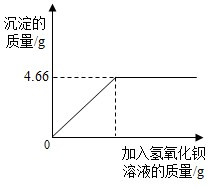 對化肥的銷售,國家規定了明確的質量要求.某農業科技人員對農民買來的鉀肥進行了檢測,稱取4.0g樣品放入小燒杯中,加入適量的水溶解后,與足量氫氧化鋇溶液充分反應.產生沉淀的質量與所加入的氫氧化鋇溶液質量的關系如圖所示.(假定雜質不參加反應,反應方程式為K2SO4+Ba(OH)2═BaSO4↓+2KOH)通過計算鉀肥中硫酸鉀的質量分數判斷該產品是否符合包裝說明?
對化肥的銷售,國家規定了明確的質量要求.某農業科技人員對農民買來的鉀肥進行了檢測,稱取4.0g樣品放入小燒杯中,加入適量的水溶解后,與足量氫氧化鋇溶液充分反應.產生沉淀的質量與所加入的氫氧化鋇溶液質量的關系如圖所示.(假定雜質不參加反應,反應方程式為K2SO4+Ba(OH)2═BaSO4↓+2KOH)通過計算鉀肥中硫酸鉀的質量分數判斷該產品是否符合包裝說明?