(2013?雨花臺區一模)實驗室欲用已配好的質量分數為10%的氫氧化鈉溶液(密度為1.1g/cm
3),配制100g質量分數為5%的氫氧化鈉溶液,并用此溶液測定某硫酸溶液的溶質質量分數.
(1)配制100g質量分數為5%的氫氧化鈉溶液,需要10%的氫氧化鈉溶液
50
50
g.
(2)配制氫氧化鈉溶液時,需要的玻璃儀器有
量筒
量筒
、滴管、燒杯、玻璃棒.
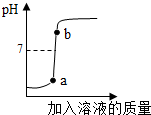
(3)用配得的氫氧化鈉溶液與待測溶質質量分數的硫酸溶液反應,實驗過程中溶液的pH變化曲線如圖所示:
①根據如圖變化曲線,判斷進行的操作是
B
B
(填字母).
A.將硫酸溶液逐滴滴加到氫氧化鈉溶液中
B.將氫氧化鈉溶液逐滴滴加到硫酸溶液中
②b點對應的溶液中的溶質為
Na2SO4、NaOH
Na2SO4、NaOH
(寫化學式).
(4)若完全中和50g稀硫酸溶液,恰好消耗配得的氫氧化鈉溶液80g.試計算該稀硫酸的溶質質量分數(請寫出計算過程)
設該稀硫酸中溶質的質量為x
2NaOH+H
2SO
4 ═Na
2SO
4 +2H
2O
80 98
80g×5% X
根據:
=解得X=4.9g
該稀硫酸的溶質質量分數為:
×100%=9.8%.
設該稀硫酸中溶質的質量為x
2NaOH+H
2SO
4 ═Na
2SO
4 +2H
2O
80 98
80g×5% X
根據:
=解得X=4.9g
該稀硫酸的溶質質量分數為:
×100%=9.8%.
.

 (2013?雨花臺區一模)實驗室欲用已配好的質量分數為10%的氫氧化鈉溶液(密度為1.1g/cm3),配制100g質量分數為5%的氫氧化鈉溶液,并用此溶液測定某硫酸溶液的溶質質量分數.
(2013?雨花臺區一模)實驗室欲用已配好的質量分數為10%的氫氧化鈉溶液(密度為1.1g/cm3),配制100g質量分數為5%的氫氧化鈉溶液,并用此溶液測定某硫酸溶液的溶質質量分數.
