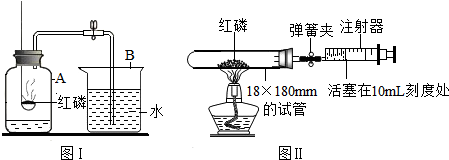
解:(1)在本實驗中用的是紅磷,紅磷在空氣中燃燒的現象:發黃光、放出熱量、冒出大量的白煙;磷和氧氣在點燃的條件下生成五氧化二磷,屬于化合反應;故答案為:發出黃光、放出熱量、冒出大量的白煙;磷+氧氣
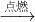
五氧化二磷;化合;
(2)本實驗還可以說明氮氣具有的化學性質有:不燃燒也不支持燃燒或不與紅磷反應;故答案為:不燃燒也不支持燃燒或不與紅磷反應
(3)如果進入集氣瓶中水的體積大于五分之一,就說明操作太慢,致使裝置內的部分空氣逸散出來.故答案為:在將燃著的紅磷伸入裝置時動作緩慢,致使裝置內的部分空氣逸散出來
(4)某學生用木炭代替圖Ⅰ中的紅磷,當木炭停止燃燒,集氣瓶冷卻到室溫,打開彈簧夾后,發現水不能進入集氣瓶,原因是:木炭燃燒生成二氧化碳氣體,占了氧氣的空間;若仍用木炭代替紅磷,對該生的實驗方案應做的改進是:在集氣瓶中放一些氫氧化鈉溶液;故答案為:木炭燃燒生成二氧化碳氣體,占了氧氣的空間;在集氣瓶中放一些氫氧化鈉溶液;
(5)圖Ⅱ是該興趣小組的測定空氣中氧氣含量的改進裝置,其實驗的操作步驟是:將少量紅磷平裝入試管中,將20mL的注射器活塞置于10mL刻度處,并按圖Ⅱ中所示的連接方式固定好,再將彈簧夾夾緊橡皮管;點燃酒精燈;撤去酒精燈,待試管冷卻后松開彈簧夾;讀取注射器活塞的數據;圖Ⅱ實驗中,注射器活塞將從10mL刻度處慢慢前移到約8mL處才停止;對照圖Ⅱ實驗,圖Ⅰ不如圖Ⅱ嚴密;故答案為:③①②④;8;圖Ⅰ不如圖Ⅱ嚴密;
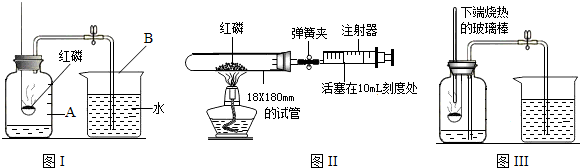
(6)圖Ⅲ的測定空氣中氧氣含量中,白磷從燃燒到熄滅冷卻的過程中,瓶內水面的變化是:先下降后上升,先下降是因為開始時,氣體受熱膨脹,冷卻后再上升;若實驗非常成功,最終集氣瓶中水的體積約為70mL,集氣瓶里預先裝進的50mL水,在實驗過程中起到的作用是:緩沖集氣瓶內氣壓的驟然升高;故答案為:先下降后上升;70;c;
分析:本題是測定氧氣在空氣中的體積分數的實驗探究,要把空氣中的氧氣消耗掉,在本實驗中用的是紅磷,紅磷在空氣中燃燒的現象:發黃光、放出熱量、冒出大量的白煙.本實驗還可以說明氮氣具有的化學性質有:不燃燒也不支持燃燒或不與紅磷反應;如果裝置內的部分空氣逸散出來,就會導致進入集氣瓶中水體積大于五分之一.某學生用木炭代替圖Ⅰ中的紅磷,當木炭停止燃燒,集氣瓶冷卻到室溫,打開彈簧夾后,發現水不能進入集氣瓶,原因是:木炭燃燒生成二氧化碳氣體,占了氧氣的空間;若仍用木炭代替紅磷,對該生的實驗方案應做的改進是:在集氣瓶中放一些氫氧化鈉溶液;圖Ⅱ是該興趣小組的測定空氣中氧氣含量的改進裝置,其實驗的操作步驟是:將少量紅磷平裝入試管中,將20mL的注射器活塞置于10mL刻度處,并按圖Ⅱ中所示的連接方式固定好,再將彈簧夾夾緊橡皮管;點燃酒精燈;撤去酒精燈,待試管冷卻后松開彈簧夾;讀取注射器活塞的數據.圖Ⅱ實驗中,注射器活塞將從10mL刻度處慢慢前移到約8mL處才停止;對照圖Ⅱ實驗,圖Ⅰ不如圖Ⅱ嚴密;圖Ⅲ的測定空氣中氧氣含量中,白磷從燃燒到熄滅冷卻的過程中,瓶內水面的變化是:先下降后上升,先下降是因為開始時,氣體受熱膨脹,冷卻后再上升;若實驗非常成功,最終集氣瓶中水的體積約為70mL,集氣瓶里預先裝進的50mL水,在實驗過程中起到的作用是:緩沖集氣瓶內氣壓的驟然升高.
點評:本考點是測定氧氣在空氣中的體積分數,屬于實驗方法和過程的探究.這類探究實驗中要注意以下幾點:①裝置的嚴密性②所用藥品的量③生成物的狀態④讀數時要冷卻到原溫度等.要具體問題具體分析,根據設計的步驟中不同的現象去思考,從而得出正確的結論.本考點經常出現在選擇題、填空題和實驗題中.

 ,你認為導致這一結果的原因是________.(只需寫一點)
,你認為導致這一結果的原因是________.(只需寫一點) 五氧化二磷;化合;
五氧化二磷;化合;

 閱讀快車系列答案
閱讀快車系列答案