
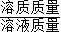 ×100%=
×100%=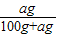 ×100%=
×100%=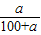 ×100%;
×100%;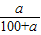 ×100%; a; Na2CO3+2HCl=2NaCl+H2O+CO2↑.
×100%; a; Na2CO3+2HCl=2NaCl+H2O+CO2↑.

科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
 (2010?瀘州)在天平兩端各放等質量的兩個錐形瓶(瓶口用單孔塞和導管連接起來,氣球中裝有等質量的大理石),如圖所示.左盤錐形瓶中盛有M 克水,右盤錐形瓶中盛有M 克稀鹽酸,天平平衡.
(2010?瀘州)在天平兩端各放等質量的兩個錐形瓶(瓶口用單孔塞和導管連接起來,氣球中裝有等質量的大理石),如圖所示.左盤錐形瓶中盛有M 克水,右盤錐形瓶中盛有M 克稀鹽酸,天平平衡.查看答案和解析>>
科目:初中化學 來源:2010年四川省瀘州市中考化學試卷(解析版) 題型:填空題

查看答案和解析>>
科目:初中化學 來源:2010年四川省瀘州市中考化學試卷(解析版) 題型:填空題
查看答案和解析>>
科目:初中化學 來源:2010年四川省瀘州市中考化學試卷(解析版) 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com