解:(1)氧化銅和稀硫酸反應生成硫酸銅和水,硫酸銅的水溶液的顏色是藍色的;
故答案為:試管中溶液變成藍色,黑色固體消失(或沒有黑色固體剩余).
(2)氧化銅和稀硫酸反應生成硫酸銅和水,硫酸銅的水溶液的顏色是藍色的;但是碳不會和硫酸反應;
故答案為:試管中溶液變成藍色,仍有黑色固體剩余.
思考:(1)根據質量守恒定律可知,反應前后元素的種類、質量均不發生改變;反應前的碳的質量是:
11.1×(
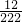
×100%)═0.6g,但是黑色粉末的質量是8g,因此排除②;
故答案為:11.1g堿式碳酸銅中含有C:
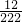
×11.1g=0.6g<8.0g.
(2)假如是氧化銅和碳的混合物,它們在高溫條件下反應生成銅和二氧化碳;也就是兩者不能共存.
實驗證明該黑色固體是氧化銅,依據質量受很定律元素的種類不變可知另外的產物是二氧化碳和水,同時可結合產物與硫酸的反應書寫堿式碳酸銅與硫酸的反應.
故答案為:在高溫下碳可以和氧化銅反應,也就是不能共存.
結論:Cu
2(OH)
2CO
3
2CuO+H
2O+CO
2↑;
反思:Cu
2(OH)
2CO
3+2H
2SO
4═2CuSO
4+3H
2O+CO
2↑.
分析:探究性題目的做法是大膽推測,但要有合理的依據,不能憑空猜想;根據質量守恒定律可知,堿式碳酸銅[Cu
2(OH)
2CO
3]的產物是有Cu、O、H、C中的一種或多種元素組合而成;根據題目信息(黑色粉末)可知,黑色物質可以是題目所說的三種情況.
實驗方案(1)根據氧化銅和硫酸的性質及其產物的顏色解決即可.
(2)根據氧化銅和硫酸的性質及其產物的顏色,結合碳不與硫酸反應的事實解決.
思考:(1)利用質量守恒定律元素的質量守恒解決即可.
(2)碳和氧化銅在高溫情況下會發生反應可知;利用實驗的事實結合質量守恒定律以及產物與硫酸的反應書寫有關的方程式即可.
點評:本題主要考查了利用所學過的知識,通過實驗探究堿式碳酸銅的受熱分解產物,其中涉及到依據碳和氧化銅的化學性質不同,選擇合適的試劑并根據實驗現象對二者進行鑒別的問題.

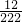 ×100%)═0.6g,但是黑色粉末的質量是8g,因此排除②;
×100%)═0.6g,但是黑色粉末的質量是8g,因此排除②;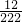 ×11.1g=0.6g<8.0g.
×11.1g=0.6g<8.0g. 2CuO+H2O+CO2↑;
2CuO+H2O+CO2↑;
