
 (1)時下有些年輕人喜歡染發,染發時一般要用到一種著色劑--對苯二胺,其化學式為C6H8N2.它是一種有毒的化學藥品,會對染發者的身體帶來傷害.
(1)時下有些年輕人喜歡染發,染發時一般要用到一種著色劑--對苯二胺,其化學式為C6H8N2.它是一種有毒的化學藥品,會對染發者的身體帶來傷害.| 硫酸的體積(mL) | 5 | 10 | 15 | 20 | 25 |
| 二氧化碳的質量(g) | 0.44 | 0.88 | a | 1.76 | 1.76 |
 =8g.
=8g.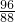 =
=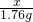
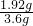 ×100%≈53.3%.故答案為:53.3%
×100%≈53.3%.故答案為:53.3%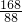 =
=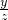
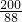 =
=


科目:初中化學 來源: 題型:閱讀理解
 (1)時下有些年輕人喜歡染發,染發時一般要用到一種著色劑--對苯二胺,其化學式為C6H8N2.它是一種有毒的化學藥品,會對染發者的身體帶來傷害.
(1)時下有些年輕人喜歡染發,染發時一般要用到一種著色劑--對苯二胺,其化學式為C6H8N2.它是一種有毒的化學藥品,會對染發者的身體帶來傷害.| 硫酸的體積(mL) | 5 | 10 | 15 | 20 | 25 |
| 二氧化碳的質量(g) | 0.44 | 0.88 | a | 1.76 | 1.76 |
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
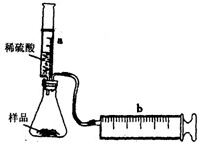
科目:初中化學 來源:2011-2012學年江蘇省蘇州市相城區九年級(上)期末化學試卷(解析版) 題型:解答題
| 硫酸的體積(mL) | 5 | 10 | 15 | 20 | 25 |
| 二氧化碳的質量(g) | 0.44 | 0.88 | a | 1.76 | 1.76 |
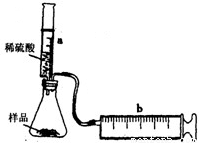
查看答案和解析>>
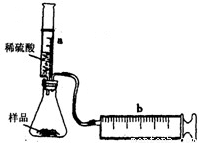
科目:初中化學 來源:2012年甘肅省平涼市莊浪縣陽川中學中考化學模擬試卷(七)(解析版) 題型:解答題
| 硫酸的體積(mL) | 5 | 10 | 15 | 20 | 25 |
| 二氧化碳的質量(g) | 0.44 | 0.88 | a | 1.76 | 1.76 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com