小明同學打算自己探究一下MnO2在分解過氧化氫時所起的作用,但手邊沒有現成的MnO2藥品,只有高錳酸鉀,30%過氧化氫溶液、木條、水、火柴,其它儀器可任選.
(1)若要先得到MnO2粉末,反應原理是(用化學式表示化學反應)________,裝置為________(用圖示)
(2)已知實驗(1)中試管中剩下兩種物質,其中二氧化錳難溶于水,而另一種易溶于水,小明用了一種方法將它們分離開來,步驟為:①________,②________.
(3)小明認為若要探究MnO2在較低的溫度下對分解H2O2有無催化作用,需作對比實驗,他設計了三組實驗:
①在試管中加入5ml 30%的過氧化氫溶液,把帶火星的木條伸入試管,看木條是否復燃.
②…;
③在第3支試管中加入5ml 30%過氧化氫溶液,并加入少量二氧化錳,把帶火星的木條伸入試管,觀察木條是否復燃.
你認為小明設計的第2組實驗過程應為:________.
(4)小明得到的是③中有O2放出,但他認為③中有O2放出是因為MnO2與H2O2發生了反應,你如何幫他設計實驗來說明MnO2沒有和H2O2起反應,而只是起了催化作用?
解:高錳酸鉀加熱生成錳酸鉀、二氧化錳和氧氣.生成的二氧化錳可做催化劑.利用錳酸鉀和二氧化錳在水中的水溶性不同,可將二氧化錳分離開來.在驗證二氧化錳做催化劑時,首先設計只有雙氧水時,是否能迅速放出氧氣.再設計只有二氧化錳時,能否放出氧氣.
故答案為:(1)KMnO4
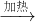
K
2MnO
4+MnO
2+O
2;試管、鐵架、酒精燈.
(2)溶解;過濾.
(3)在第二支試管加入少量二氧化錳,把帶火星的木條伸入試管,觀察木條是否復燃.
(4)將反應后所得固體過濾,洗滌,然后再將所得的固體加入盛雙氧水的試管中,然后在試管口處,放一帶火星的木條,觀察木條復燃,說明二氧化錳沒有跟雙氧水發生反應,只是改變反應速率.
分析:催化劑是改變化學反應的速率,而反應前后催化劑的質量和化學性質保持不變.
點評:在驗證二氧化錳的質量反應前后是否改變,可將反應后的固體過濾,干燥稱量固體質量.

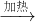 K2MnO4+MnO2+O2;試管、鐵架、酒精燈.
K2MnO4+MnO2+O2;試管、鐵架、酒精燈.

 長江作業本同步練習冊系列答案
長江作業本同步練習冊系列答案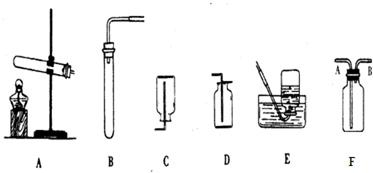 27、化學實驗室里,老師給同學們準備了如下實驗裝置:
27、化學實驗室里,老師給同學們準備了如下實驗裝置: