解:(1)CO是可燃性氣體,不純點燃會發生爆炸,所以應先讓CO充滿整個裝置,故實驗開始時先加熱A處的酒精燈,使產生的一氧化碳排凈裝置內的空氣;實驗結束時,為防止生產的鐵被氧化,要繼續通一會CO直至裝置冷卻,所以要先熄滅D處酒精燈;從環保的角度考慮為防止有毒的未反應的一氧化碳通過E進入空氣應在E后對一氧化碳進行處理;
(2)B裝置中的氫氧化鈉溶液可以吸收A裝置中產生的二氧化碳,防止二氧化碳干擾D中的反應;E裝置中的氫氧化鈉溶液可以吸收D中生成的二氧化碳,并收集一氧化碳.一氧化碳還原氧化鐵的化學反應式是:3CO+Fe
2O
3
3CO
2+2Fe.
(3)設樣品中氧化鐵的質量為X,由提供的數據
3CO+Fe
2O
3
3CO
2+2Fe質量之差m
160 112 160-112=48
X 10g-7.6g═2.4g

=

解得:X=8g
化鐵樣品中氧化鐵的質量分數為:
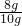
×100%=80%
(4)E裝置在反應后增加的質量是反應中生成的二氧化碳的質量,如果B裝置吸收CO
2不充分或E吸收了裝置里空氣中的CO
2或者外界CO
2進入的干擾,就會使二氧化碳的質量增大,實際測定結果就會偏大:
故答案為:(1)A;先;沒有對反應中剩余的一氧化碳進行處理;(2)吸收A中反應生成的二氧化碳;吸收D中反應生成的二氧化碳,并且收集一氧化碳;3CO+Fe
2O
3
3CO
2+2Fe.
(3)80%;(4))B裝置吸收CO
2不充分;E吸收了裝置里空氣中的CO
2或者外界CO
2進入的干擾(給出一條合理答案即可).
分析:(1)CO不純,點燃可能會引起爆炸,應讓CO充滿整個裝置,所以要先讓A中反應發生,結束時為防止鐵被氧化,要繼續通一會CO,所以要先停止D加熱;從環保的角度考慮一氧化碳對空氣的污染即可.
(2)根據B裝置中氫氧化鈉溶液可以吸收二氧化碳分析;根據反應物、反應條件、生成物寫出化學方程式;
(3)根據一氧化碳還原氧化鐵的化學反應式和提供的數據利用量差法進行計算即可.
(4)從裝置B吸收二氧化碳時的不充分或E可能吸收空氣中的二氧化碳等方面進行分析即可;
點評:本題考查了一氧化碳還原氧化鐵的反應原理、步驟、實驗現象、尾氣處理以及應用.要注意有毒氣體不能隨意排放,必須經過處理后變成無害物質再排放.

 某校化學課外興趣小組的同學在研究性學習課展示了一套如圖所示的實驗裝置(假設每步化學反應都完全,氧化鐵樣品中的雜質不反應).查閱資料:草酸在濃硫酸存在時加熱發生如下反應:
某校化學課外興趣小組的同學在研究性學習課展示了一套如圖所示的實驗裝置(假設每步化學反應都完全,氧化鐵樣品中的雜質不反應).查閱資料:草酸在濃硫酸存在時加熱發生如下反應: CO↑+CO2↑+H2O,通過討論,同學們對這套裝置有了多種認識.
CO↑+CO2↑+H2O,通過討論,同學們對這套裝置有了多種認識. 3CO2+2Fe.
3CO2+2Fe. 3CO2+2Fe質量之差m
3CO2+2Fe質量之差m =
=
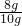 ×100%=80%
×100%=80% 3CO2+2Fe.
3CO2+2Fe.

 某校化學課外興趣小組的同學在研究性學習課上展示了一套如下圖所示實驗裝置(假設每步化學反應都完全,氧化鐵樣品中的雜質不參加反應).查閱資料:草酸在濃硫酸存在時加熱發生如下反應:H2C2O4
某校化學課外興趣小組的同學在研究性學習課上展示了一套如下圖所示實驗裝置(假設每步化學反應都完全,氧化鐵樣品中的雜質不參加反應).查閱資料:草酸在濃硫酸存在時加熱發生如下反應:H2C2O4
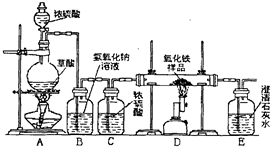 某校化學課外興趣小組的同學在研究性學習課展示了一套如圖所示的實驗裝置(假設每步化學反應都完全,氧化鐵樣品中的雜質不反應).查閱資料:草酸在濃硫酸存在時加熱發生如下反應:
某校化學課外興趣小組的同學在研究性學習課展示了一套如圖所示的實驗裝置(假設每步化學反應都完全,氧化鐵樣品中的雜質不反應).查閱資料:草酸在濃硫酸存在時加熱發生如下反應: