
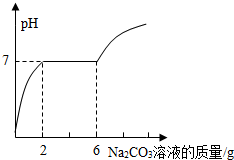
 某實驗小組的同學用氫氧化鋇溶液和鹽酸進行酸堿中和反應的實驗時,向燒杯中的氫氧化鋇溶解加入一定量稀鹽酸后,發現忘記了滴加指示劑.因此,他們停止滴加稀鹽酸,并對燒杯內溶液中的溶質成分進行探究.
某實驗小組的同學用氫氧化鋇溶液和鹽酸進行酸堿中和反應的實驗時,向燒杯中的氫氧化鋇溶解加入一定量稀鹽酸后,發現忘記了滴加指示劑.因此,他們停止滴加稀鹽酸,并對燒杯內溶液中的溶質成分進行探究.分析 Ⅰ、【猜想】
根據反應的程度進行猜想:恰好反應、一種物質完全反應,另一種物質有剩余;
氫氧化鋇和鹽酸不能共存;
【進行實驗】根據酚酞遇堿變紅來進行解答;
據碳酸鈉與鹽酸和氯化鋇反應的現象解答;
【反思與拓展】
(1)根據實驗的結論進行發生反思;
(2)根據酸會與鐵反應進行分析.據除雜的原則分析;
Ⅱ(1)由圖可知,當碳酸鈉溶液質量加到 2g時,溶液中鹽酸恰好處理完,溶液呈中性.
(2)據化學方程式進行相關計算.
解答 解:
Ⅰ、【猜想】反應可能是恰好反應,只有氯化鋇(猜想三)、也可能是一種物質完全反應,另一種物質有剩余,若氫氧化鋇過量,則含有氫氧化鋇和氯化鋇(猜想二);若鹽酸過量,則含有鹽酸和氯化鋇(猜想四);猜想一一定不正確,因鹽酸與氫氧化鋇不能共存.
【進行實驗】因為酚酞遇堿會變紅色,而結論是猜想二不正確,即不含有氫氧化鋇,故觀察到的現象是溶液不變紅色;
取少量燒杯內溶液于另一支試管中,逐滴加入碳酸鈉溶液至過量,而結論是猜想三不成立,猜想四成立,故實驗現象:鹽酸與碳酸鈉反應產生氣泡,鹽酸消耗掉后,氯化鋇再與碳酸鈉反應產生沉淀;
結論:【反思與拓展】
(1)因為反應可能是完全反應,也可能是其中的一種反應物過量,因此在分析化學反應后所得物質成分時,除考慮生成物外還需考慮反應物的用量;
(2)鹽酸會與鐵反應而將下水道腐蝕;要處理燒杯內的溶液,把鹽酸除去,使其溶質只含有BaCl2,應向燒杯中加入過量的BaCO3,因碳酸鋇與鹽酸反應生成氯化鋇和水、二氧化碳,不會產生新的雜質.
Ⅱ(1)由圖可知,當碳酸鈉溶液質量加到2g時,溶液中鹽酸恰好處理完,溶液呈中性.
(2)解 設原燒杯溶液中BaCl2的質量為x,
BaCl2+Na2CO3═BaCO3↓+2NaCl
208 106
x (6g-2g)×13.25%=0.53g
$\frac{208}{x}$=$\frac{106}{0.53g}$
x=1.04g(1分)
原燒杯溶液中氯化鋇的質量分數$\frac{1.04g}{10g}$×100%=10.4%
答:原燒杯溶液中氯化鋇的質量分數是10.4%.
故答案為:【猜想】BaCl2;猜想一;
【進行實驗】溶液無明顯變化(或溶液不變紅色);先有氣體產生,后產生沉淀;
【反思與拓展】
反應物的用量;腐蝕鐵質下水管(或污染水源);
BaCO3;
Ⅱ(1)2;
(2)10.4%.
點評 本題考查了酸堿中和反應以及實驗設計的能力.設計實驗時,可以從反應后的產物和其有關的性質著手.


科目:初中化學 來源: 題型:選擇題
| A. | 用氯化鉀制氯化鈉KCl+NaNO3=NaCl+KNO3 | |
| B. | 用二氧化碳制碳酸飲料CO2+H2O=H2CO3 | |
| C. | 用電解水的方法測定水的組成2H2O=2H2↑+O2↑ | |
| D. | 用氫氧化鈉制碳酸鈉Na2CO3+Ca(OH)2=CaCO3↓+2NaOH |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 化學與生活、生產關系密切.請回答下列問題:
化學與生活、生產關系密切.請回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
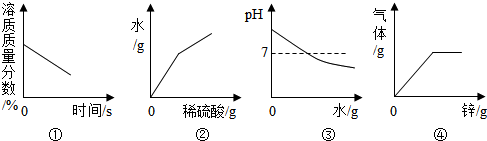
| A. | 圖①:將接近飽和的硝酸鉀溶液緩慢降溫 | |
| B. | 圖②:向一定量的氫氧化鋇溶液中加過量稀硫酸,生成水的質量與加進稀硫酸的質量關系圖 | |
| C. | 圖③:向氫氧化鈉溶液中加水 | |
| D. | 圖④:向一定量的稀硫酸中加入過量的鋅 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 二氧化碳(一氧化碳)--通過足量的氫氧化鈉溶液、干燥 | |
| B. | 硫酸亞鐵溶液(硫酸銅)--加過量的鋅粉、過濾 | |
| C. | 氫氧化鈉(碳酸鈉)--加適量的稀鹽酸、蒸發 | |
| D. | 氮氣(氧氣)--通過灼熱的銅網 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com