
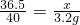 解之得:x=2.92g
解之得:x=2.92g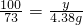 解之得 y=6g
解之得 y=6g 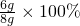 =75%.
=75%.

 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
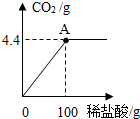 (2011?梧州)廣西具有豐富的石灰石資源.化學興趣小組欲測定某石灰石樣品中CaCO3的質(zhì)量分數(shù),取石灰石樣品15g,加入適量稀鹽酸(雜質(zhì)不溶于水,也不與鹽酸反應),消耗稀鹽酸的質(zhì)量與放出二氧化碳的質(zhì)量關系如圖所示,請你計算:
(2011?梧州)廣西具有豐富的石灰石資源.化學興趣小組欲測定某石灰石樣品中CaCO3的質(zhì)量分數(shù),取石灰石樣品15g,加入適量稀鹽酸(雜質(zhì)不溶于水,也不與鹽酸反應),消耗稀鹽酸的質(zhì)量與放出二氧化碳的質(zhì)量關系如圖所示,請你計算:查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com