

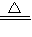 2AlN+3CO;
2AlN+3CO;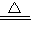 3Cu+3H2O+N2;
3Cu+3H2O+N2;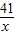 =
=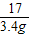 x=8.2g
x=8.2g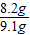 ×100%=90%.
×100%=90%.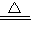 2AlN+3CO;
2AlN+3CO;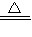 3Cu+3H2O+N2;
3Cu+3H2O+N2;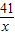 =
=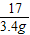 x=8.2g
x=8.2g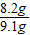 ×100%=90%.
×100%=90%.

科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源:江蘇省揚州中學教育集團樹人學校2012年中考第二次模擬考試化學試題 題型:022
(1)常見的綠色凈水劑、消毒劑有:①高鐵酸鉀(K2FeO4)②聚合硫酸鐵([Fe2(OH)n(SO4)3-n/2]m,簡稱聚鐵)③二氧化氯(ClO2),這3種物質中共含有________(填數字)種非金屬元素,高鐵酸鉀與水反應生成一種紅褐色的氫氧化物________(填化學式),該物質對水中的雜質有絮凝作用.ClO2制備方法較多,我國科學家探索的新方法是:氯氣(Cl2)和固體亞氯酸鈉(NaClO2)反應生成一種常見的鹽和ClO2,反應方程式為________.
(2)氮化鋁(AlN)具有耐高溫、抗沖擊、導熱性好等優良性質,被廣泛應用于大規模集成電路生產、陶瓷工業等領域.工業上從鋁土礦中獲得物質X,從空氣中獲得氮氣,再將物質X、N2和碳在一定條件下反應制得AlN和CO.氮化鋁陶瓷屬于________(填“金屬材料”或“無機非金屬材料”).物質X的化學式________,經估算,AlN中N元素質量分數________(填“大于”或“小于”)NH4NO3中N元素質量分數.
(3)疊氮化鈉(NaN3)被廣泛應用于汽車安全氣囊.汽車經撞擊后,30毫秒內引發NaN3迅速分解為Na、N2,反應方程式為________.汽車尾氣中有毒的CO和NOx經特殊的催化裝置后,轉化為兩種無色無味無毒的常見氣體是________、________.
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源:2012年江蘇省揚州中學教育集團樹人學校中考化學二模試卷(解析版) 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com