(2011?豐臺區一模)取某碳酸鈉樣品50g(含氯化鈉和13%的不溶性雜質,雜質不參加化學反應),放入質量為200g的燒杯中,加137.7g水充分溶解,再向燒杯中加入300g稀鹽酸恰好完全反應,測得反應后燒杯與燒杯內物質的總質量為674.5g.求所得溶液中溶質的質量分數.
【答案】
分析:運用質量守恒定律,分析變化前后質量的改變,可求出恰好完全反應所放出二氧化碳的質量,根據反應的化學方程式,由二氧化碳質量計算出生成氯化鈉及樣品中碳酸鈉的質量,最后根據溶液中溶質質量分數計算公式求出反應后所得溶液的溶質質量分數.
解答:解:根據質量守恒定律,生成二氧化碳氣體的質量為50g+200g+137.7g+300g-674.5g=13.2g
設樣品中含碳酸鈉的質量為x,反應后生成的氯化鈉的質量為y
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
106 117 44
x y 13.2g
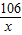
=
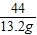
x=31.8g
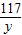
=
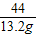
y=35.1g
所得溶液中的溶質=35.1g+(50g-31.8g-50g×13%)=46.8g
所得溶液的總質量=674.5g-200g-50g×13%=468g
所得NaCl溶液中溶質的質量分數=
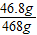
×100%=10%
答:反應后溶液中溶質的質量分數為10%.
點評:根據質量守恒定律,分析反應前后質量變化而得到生成氣體二氧化碳的質量及反應后所得溶液質量,體現分析問題、解決問題的能力.

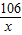 =
=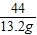 x=31.8g
x=31.8g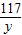 =
=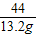 y=35.1g
y=35.1g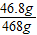 ×100%=10%
×100%=10%
